2021年12月8日,中国首个抗新冠特效药——安巴韦单抗/罗米司韦单抗(BRII-196/198)——获批[1],让我国抗疫进入“有苗有药”的全新阶段,一时间这个单抗组合获批的消息登上各大媒体平台的热搜。
让人没想到的是,11月9日在南非现身的奥密克戎(Omicron,B.1.1.529)毒株,在安巴韦单抗/罗米司韦单抗获批的第二天,悄然从天津登陆中国内地,给我国的抗疫工作带来巨大的压力。
在11月中旬就有研究发现:奥密克戎刺突(S)蛋白上竟出现了超过30个突变,其中仅感染人体细胞所必需的受体结合区域(RBD)上就有15个突变[2]。因此很多研究人员认为,奥密克戎必然会严重影响疫苗与单克隆抗体药物的有效性。
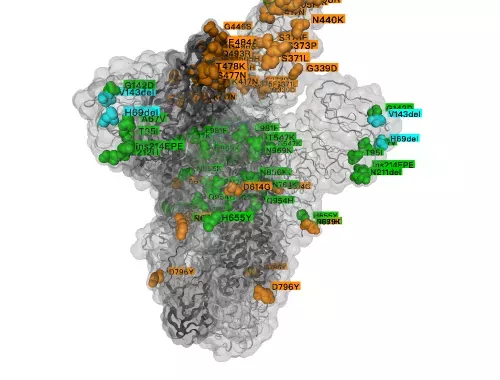
奥密克戎S蛋白上的突变(图片来源:https://www.gisaid.org/)
事实也确实如此,很快就有研究发现一些已经获批的中和抗体分别呈现出不同程度的失效[3]。一时间很多人都在担心中国首个获批抗新冠抗体组合的命运。
好消息是,12月12日傍晚,腾盛博药发布消息称:实验室中和数据表明,安巴韦单抗/罗米司韦单抗联合疗法保持对新型冠状病毒变异株奥密克戎的中和活性[4]。两天后,著名病毒学家、哥伦比亚大学医学院教授何大一团队发现,在针对奥密克戎突变株的中和实验中,19个抗体里除了Sotrovimab和罗米司韦单抗的中和活性不受影响之外,其他抗体的中和活性均有所下降[5]。
这一消息无疑给国人打了一剂“强心针”。
那么为何在大部分抗体失效的情况下,安巴韦单抗/罗米司韦单抗这一组合仍能保持对奥密克戎的中和活性呢?
单从安巴韦单抗/罗米司韦单抗这对组合来讲,我们认为至少有两个原因。接下来我们就一一介绍。
超强互补
在研发初始,在抗病毒领域颇有经验的腾盛博药团队就选择了中和抗体组合疗法,而且选择了一对互补性超强的中和抗体。这样做的目的,其实就是为了避免耐药。
实际上,在2020年6月份,就已经有团队发现,不竞争或者部分竞争的中和抗体组合可以避免新冠突变体的逃逸[6]。这也是FDA批准的基本都是抗体组合的原因。

新冠病毒 S蛋白模型(图片来源:NIAID-RML)
既然如此,那为什么有些组合的中和效果就大打折扣,而安巴韦单抗/罗米司韦单抗的中和效果却保持的很好呢?要回答这个问题,我们得从抗体的互补性和中和机制入手。
众所周知,目前的中和抗体都是靶向新冠病毒S蛋白的RBD。要知道,RBD虽小,但是可供中和抗体结合的位点却是不少。中和抗体与RBD结合的位置不同,必然对中和抗体的效果存在一定的影响。
早在2020年,华盛顿大学David Veesler团队就借助冷冻电子显微镜,研究了中和抗体抗原结合段(Fab)与新冠病毒S蛋白三聚体结合的位点,最终在S蛋白的RBD上确定了6个不同的位点(Ia,Ib,IIa,IIb,IIc和IV)[7]。
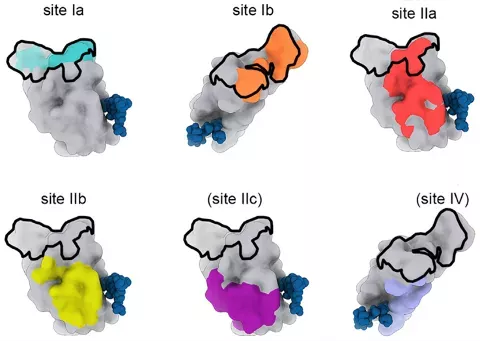
6个不同的结合位点(其中黑色框代表ACE2与RBD的结合位点,其他6种颜色分别代表单抗与RBD结合的位点)
从上图不难发现,Ia和Ib这两个位点均与ACE2与RBD的受体结合基序(RBM)有重合,但是重合的区域和方式有所不同。结合Ia位点的中和抗体仅在RBD打开状态下才能与之结合,且与RBM重合的区域较Ib类抗体更大。而结合Ib位点的中和抗体在RBD打开或关闭状态下均可与之结合,并部分覆盖RBM区域。因此结合这两个位点的中和抗体,都是通过与ACE竞争,阻止新冠病毒感染人体细胞[7,8]。换句话说,结合Ia或Ib位点的抗体存在竞争性,互补性不强。
IIa,IIb和IIc都是与RBD隐蔽位点结合的抗体,且只有在RBD打开时才能与之结合,其中IIa与RBM部分重合,IIb和IIc逐渐远离RBM[7,8]。虽然仅从位点上看三者不与ACE2竞争,但是有研究发现,中和抗体结合上这三个位点之后,会在其他地方或者空间上阻碍ACE2与RBD的结合[7,8]。
IV这个位点最为特殊,它不仅远离RBD的核心RBM,而且有研究表明,结合到这个位点上的抗体不会与ACE2存在竞争关系[7,9]。而且,无论RBD是打开还是关闭,抗体都可以结合到这个位点。
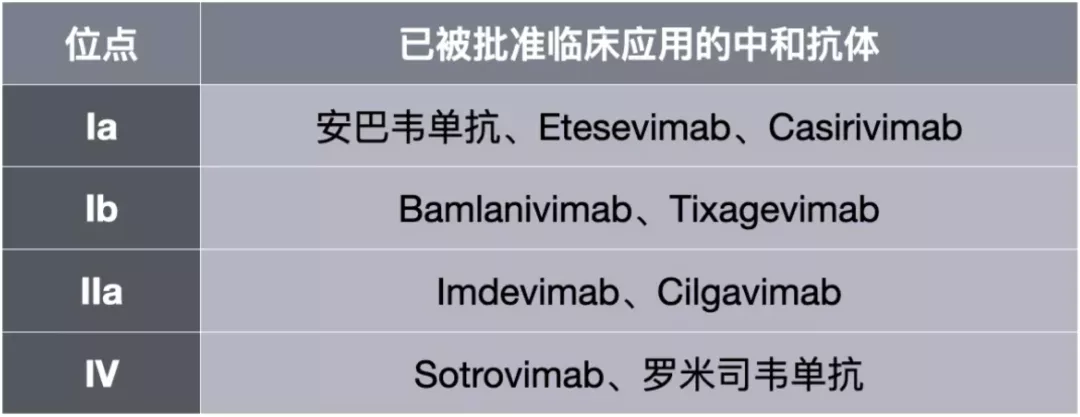
已经被批准临床应用的部分中和抗体与RBD的结合位点[7,8]
通过以上的描述不难看出:结合IV位点的中和抗体与结合Ia和Ib这两个位点的中和抗体的互补性最强。巧的是,安巴韦单抗的结合位点就是Ia,而罗米司韦单抗的结合位点就是IV[5,7,8],因此二者的互补性确实是超强。
再来看安巴韦单抗/罗米司韦单抗的中和机制。
已有研究表明,安巴韦单抗与RBM的结合表位和ACE2与RBM的结合表位高度一致[10]。这种高度重合的特征,不仅赋予了安巴韦单抗更强的竞争结合能力,还使其更能应对因RBD部分表位突变引起的病毒逃逸[11]。
至于罗米司韦单抗,它结合的是IV位点,与结合Ia的安巴韦单抗不存在竞争关系。就在前不久,有研究团队发现,结合IV位点的抗体可抑制病毒与细胞发生膜融合所必须的S蛋白重排,从而抑制病毒膜融合的发生,阻止病毒入侵细胞[12]。
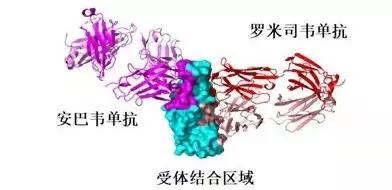
安巴韦单抗/罗米司韦单抗结合RBD示意图(腾盛博药供图)
总的来说,这种超强的结合位点互补性和不同的抗病毒机制,或许就是安巴韦单抗/罗米司韦单抗联合疗法对奥密克戎保持中和活性的原因之一。
超高血药浓度
那么安巴韦单抗/罗米司韦单抗联合疗法对奥密克戎的中和活性究竟保持的如何呢?毕竟结合Ia位点的安巴韦单抗中和活性有所下降[5]。
虽然,体外实验表明,奥密克戎对安巴韦的中和活性有一定影响,但安巴韦单抗/罗米司韦单抗联合使用之后,受到的影响并不大[13]。除了前面介绍的互补性之外,血药浓度也是维持中和活性的一大助力。
我们先来看看注射安巴韦单抗/罗米司韦单抗后,患者的血药浓度。为了尽快提升血药浓度增强抗病毒效果,结合1期临床数据,在保证安全性的前提下,腾盛博药的研究人员选择了单次大剂量给药(1000mg/1000mg)的方式(NCT04518410)。
单次静脉给药之后,仅需约5个小时血液抗体的浓度就能超过300μg/ml,这个血药浓度是IC50的1000倍以上,肺部浓度是IC50的100倍以上(腾盛博药未公开数据)。也就是说,单从注射后的血药浓度来看,安巴韦单抗/罗米司韦单抗足以对付奥密克戎突变株。
新冠病毒(图片来源:NIAID-RML)
此外,值得一提的是,安巴韦单抗/罗米司韦单抗的可结晶段(Fc)是经过修饰改造的。这一改造带来两个好处,一方面是使安巴韦单抗/罗米司韦单抗的半衰期达到普通抗体的2-3倍,从21天延长到46-76天[14,15];另一方面,会显著增加靶器官(肺部)的药物分布,提高肺部抗体浓度[16]。毫无疑问,这两点对于中和抗体活性的维持也至关重要。
正是以上的两个原因,让安巴韦单抗/罗米司韦单抗对奥密克戎的中和活性得以维持。当然了,背后的具体机制还有待更深入的研究。
总的来说,从现有的研究来看,安巴韦单抗和罗米司韦单抗结合于RBD的两个完全不同、且互不干扰的位点,这让它们实现了真正的功能互补。另外,患者治疗后的超高血药浓度以及更高的肺部抗体浓度,也对安巴韦单抗/罗米司韦单抗对目前已知的所有变异株保持中和活性助力不小。
据了解,清华大学张林琦团队关于安巴韦单抗/罗米司韦单抗中和奥密克戎的研究即将发表,期待张教授给我们带来更全面的解答。
参考文献
[1].https://www.nmpa.gov.cn/yaowen/ypjgyw/20211208212528103.html
[2].https://www.krisp.org.za/manuscripts/25Nov2021_B.1.1.529_Media.pdf
[3].Cao Y R, Wang J, Jian F, et al. B. 1.1. 529 escapes the majority of SARS-CoV-2 neutralizing antibodies of diverse epitopes[J]. BioRxiv, 2021.
[4].https://mp.weixin.qq.com/s/48JorUncaQ_isz07rBpVPw
[5].Liu L, Iketani S, Guo Y, et al. Striking Antibody Evasion Manifested by the Omicron Variant of SARS-CoV-2[J]. nature, 2021.
[6].Baum A, Fulton B O, Wloga E, et al. Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies[J]. Science, 2020, 369(6506): 1014-1018.
[7].Piccoli L, Park Y J, Tortorici M A, et al. Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology[J]. Cell, 2020, 183(4): 1024-1042. e21.
[8].Corti D, Purcell L A, Snell G, et al. Tackling COVID-19 with neutralizing monoclonal antibodies[J]. Cell, 2021.
[9].Pinto D, Park Y J, Beltramello M, et al. Cross-neutralization of SARS-CoV-2 by a human monoclonal SARS-CoV antibody[J]. Nature, 2020, 583(7815): 290-295.
[10].Ge J, Wang R, Ju B, et al. Antibody neutralization of SARS-CoV-2 through ACE2 receptor mimicry. Nat Commun. 2021;12(1):250. Published 2021 Jan 11.
[11]. Baum A, Fulton B O, Wloga E, et al. Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies[J]. Science, 2020, 369(6506): 1014-1018.
[12].Lempp FA, Soriaga LB, Montiel-Ruiz M, et al. Lectins enhance SARS-CoV-2 infection and influence neutralizing antibodies. Nature. 2021;598(7880):342-347.
[13].https://opendata.ncats.nih.gov/variant/activity
[14].Zhang Y, Hao X, Ma J, et al. Phase 1 safety and pharmacokinetics studies of BRII-196 and BRII-198, SARS-CoV-2 spike-targeting monoclonal antibodies[J]. medRxiv, 2021.
[15]. Robbie G J, Criste R, Dall'Acqua W F, et al. A novel investigational Fc-modified humanized monoclonal antibody, motavizumab-YTE, has an extended half-life in healthy adults[J]. Antimicrobial agents and chemotherapy, 2013, 57(12): 6147-6153.
[16].Shah DK, Betts AM. Antibody biodistribution coefficients: inferring tissue concentrations of monoclonal antibodies based on the plasma concentrations in several preclinical species and human. MAbs. 2013;5(2):297-305. doi:10.4161/mabs.23684


