36岁中年男性,主因发热、咳嗽3天,呼吸困难1天于10月28日至中日友好医院急诊就诊,胸部CT示双肺多发沿支气管分布团片状高密度影。患者氧合进行性恶化,当天接受气管插管、呼吸机辅助通气及体外膜肺支持治疗。支气管镜检查获取病原学,证实为乙型流感病毒及金黄色葡萄球菌混合感染。虽然经过抗感染、抗休克以及体外膜肺等终极手段在内的脏器支持治疗,仍呈现感染播散,患者最终因难以纠正的脓毒性休克于入院13天后死亡。为何一例既往体健的患者仅因为一次「感冒」最终死亡,流感病毒如何感染患者肺部并导致免疫功能全面崩溃?我们希望通过这例病例解密不一样的流感。
临床资料
一般资料:
36岁,男性,主因发热、咳嗽3天,呼吸困难伴胸痛1天于2021-10-28收入我院呼吸与危重症医学科MICU。
现病史:
患者3天前(10-25)受凉后出现间断发热,Tmax39.7℃,伴畏寒、寒战,伴鼻塞、咽痛,伴咳嗽、咳黄痰,量多,不易咳出。无胸闷、胸痛,无恶心、呕吐,无腹痛、腹泻,无尿频、尿急、尿痛,就诊于外院发热门诊,查血常规:WBC 5.49×109/L、LYM 0.6×109/L,CRP、PCT正常。新型冠状病毒核酸阴性,新型冠状病毒IgG、IgM阴性,甲流及乙流病毒抗原快速检测阴性。10-26胸部CT未见明显异常,予对乙酰氨基酚口服退热对症治疗,近2日工友发现其精神差,嗜睡。1天前出现呼吸困难,伴剑突下疼痛,与呼吸运动相关。
10-28就诊于我院急诊,心电监护示:SpO2 90%,血压134/82mmHg,呼吸22次/分,心率138次/分,心电图示窦性心动过速。血气分析(鼻导管吸氧3L/min):pH 7.48,PaO2 67mmHg,PaCO2 29mmHg,HCO3- 21.6mmol/L,BE -0.5mmol/L,Lac 2.4mmol/L。血常规:WBC 1.59×109/L,NEUT 1.11×109/L,LYM 0.35×109/L。hs-CRP 78.43mg/L;CK 211 IU/L。10-28复查胸部CT提示:两肺多发沿支气管分布团片状高密度影。予气管插管接呼吸机辅助机械通气,PC模式PC12cmH2O,PEEP 5cmH2O,FiO2 1.0。
既往史及个人史:
既往体健。于2021-01-12,2021-01-28接种新冠疫苗,无新冠确诊及疑似病人接触史,无中高风险地区旅居史。建筑工人,有集体宿舍生活史。吸烟史10年余,10-20支/日,余无特殊。
入院查体:
T 39℃,HR 148次/分,BP 106/66mmHg(去甲肾上腺素0.3μg/kg/min),RR 30次/分,SpO2 81%(IPPV,FiO2 1.0)。经口气管插管,镇痛镇静状态。双肺呼吸音粗,右下肺可闻及较多湿啰音。心率148次/分,律齐,各瓣膜听诊区未闻及心脏杂音。腹部膨隆,压之无痛苦表情,肠鸣音4次/分。双侧病理征(-)。
辅助检查
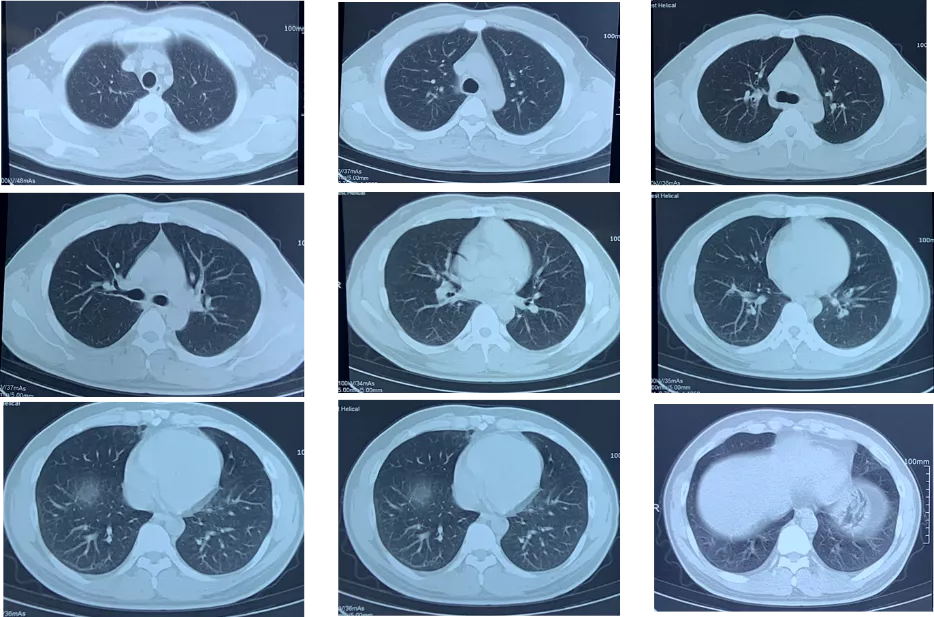
图1:10-26(起病1天)胸部CT
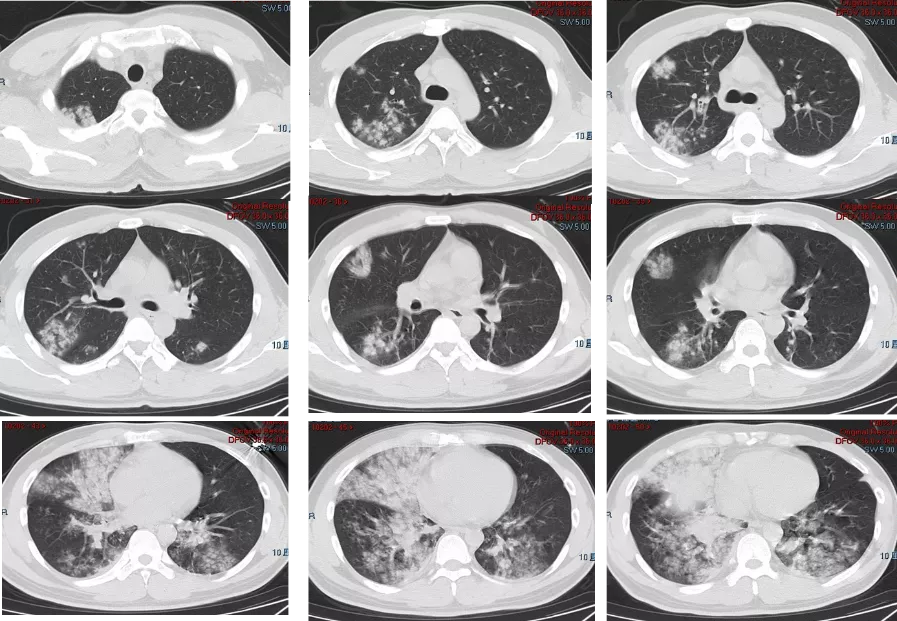
图2:10-28(起病3天)胸部CT
入院诊断
1. 急性呼吸窘迫综合征(重度);2.重症社区获得性肺炎;3.脓毒性休克
入院后检查:
10-28血常规:WBC 0.7×109/L,NEUT 0.45×109/L,LYM 0.21×109/L。hs-CRP 167.64mg/L;PCT 35.64 ng/ml。
气管镜检查:各叶段支气管开口通畅,粘膜充血水肿明显,触之易出血,各叶段管腔内可见大量黄色粘稠分泌物,并有较多的鲜血渗出,以双下肺各管口为著,予充分吸净,未见溃疡糜烂,未见新生物,吸出物有臭味。
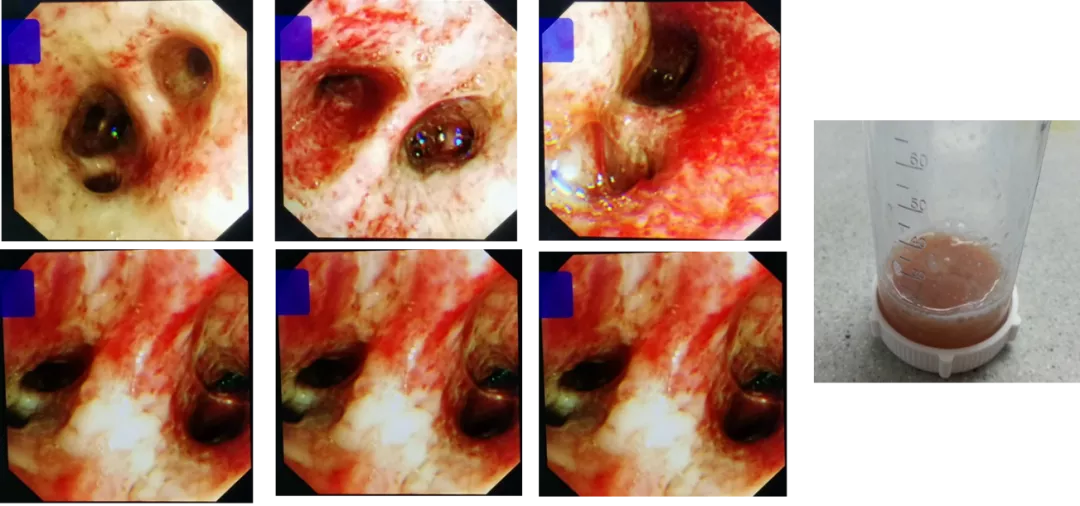
图3:气管镜检查见粘膜充血水肿明显,触之易出血,收集下呼吸道脓血性分泌物
病原学回报:2021-10-29 BALF 乙型流感病毒核酸(+),金黄色葡萄球菌培养阳性(MSSA),真菌涂片、培养(-);甲型流感病毒、腺病毒、呼吸道合胞病毒等病毒核酸检测(-)。2021-10-29~11-5 4套外周血培养(需氧+厌氧):金黄色葡萄球菌(MSSA)。
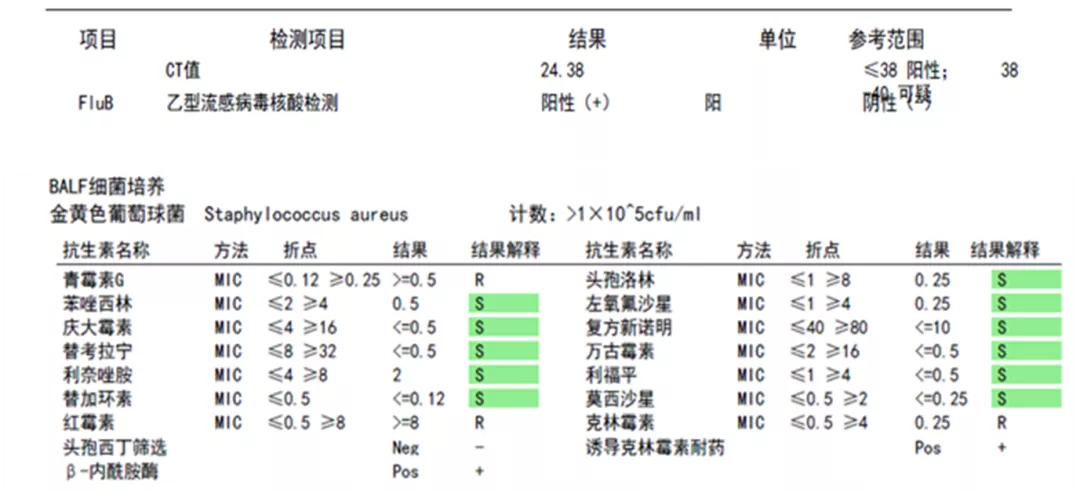
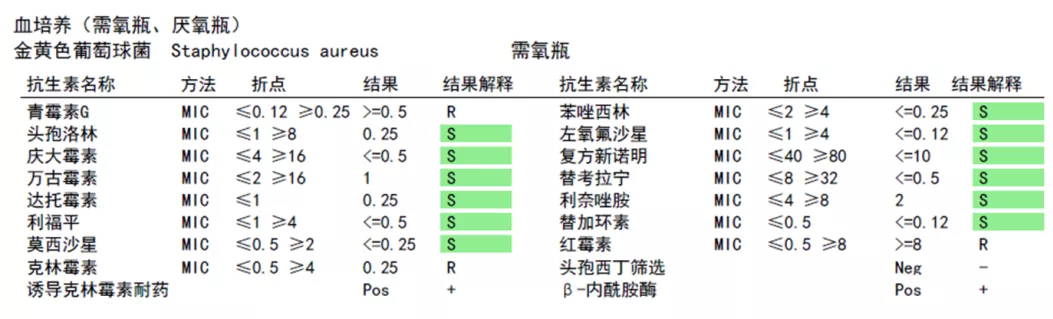
图4:BALF及血病原学结果,均可见MSSA阳性,药敏结果一致
10-29 血清G试验,GM试验、BALF GM试验、TB-SPOT均阴性。
10-30复查血清GM试验2.6↑
患者入院后感染指标变化如下:
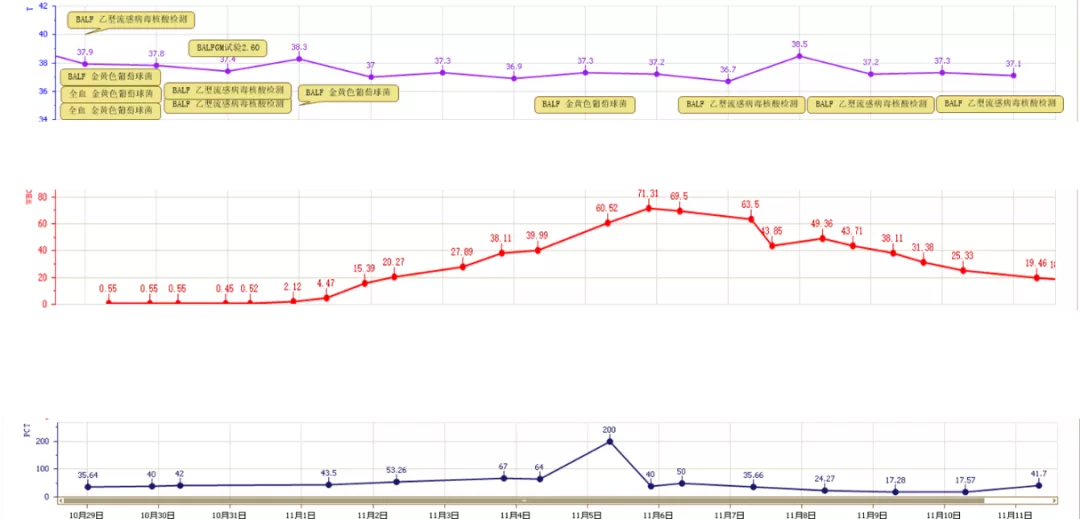
图5:体温、白细胞总数、PCT变化及病原学检出结果
患者入院后呈现粒细胞缺乏状态,经升白等治疗后表现为类白血病反应。血小板明显减低。
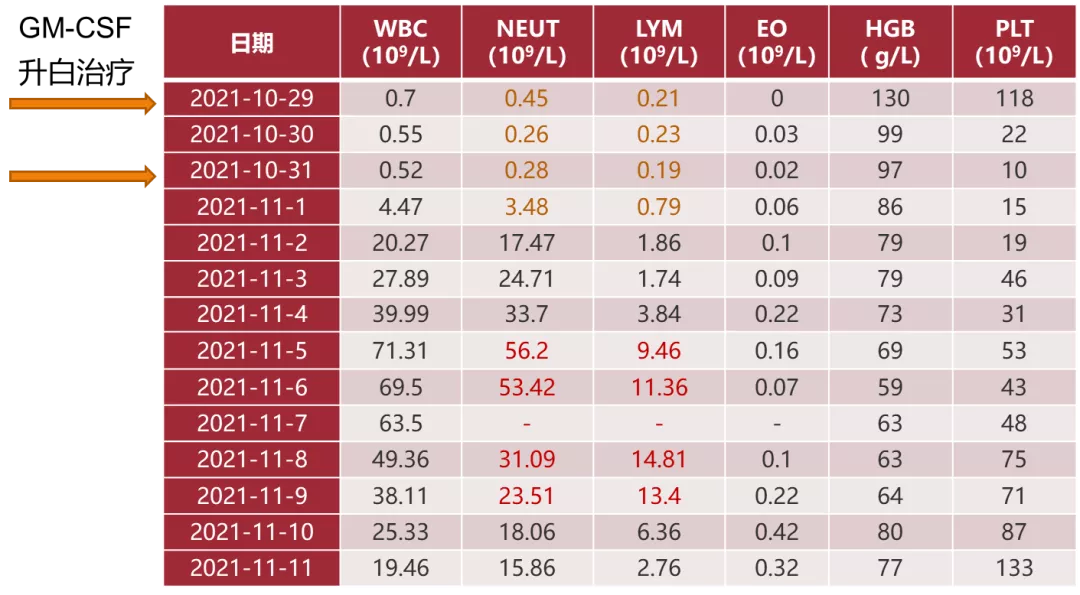
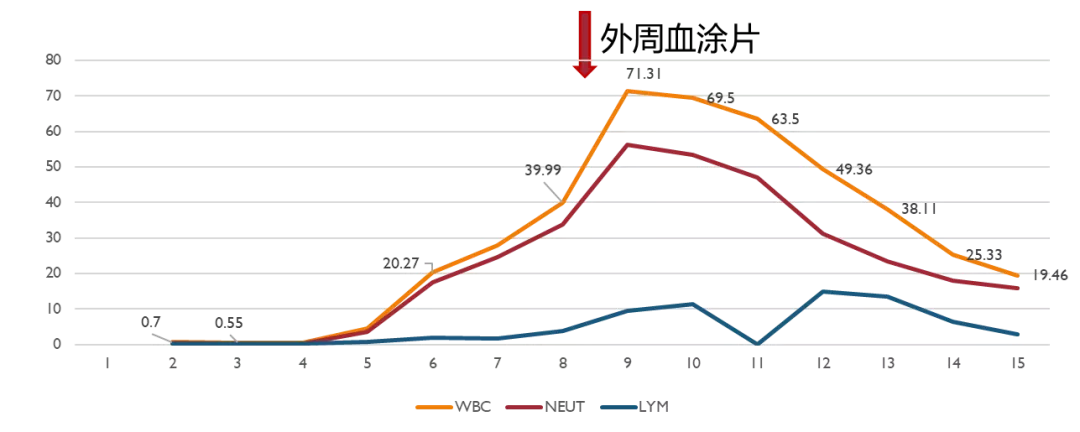
图6:入院后血三系变化
11-6 外周血涂片:分叶2/50 ↓ 、单核2/50 ↓、白细胞明显减少,可见中、晚幼粒,中性粒细胞可见、中毒颗粒及空泡变性,淋巴比例高。成熟红细胞形态大致正常,PLT 血小板减少。
同时合并多脏器受累,持续无尿,肝功能检查提示胆酶分离。
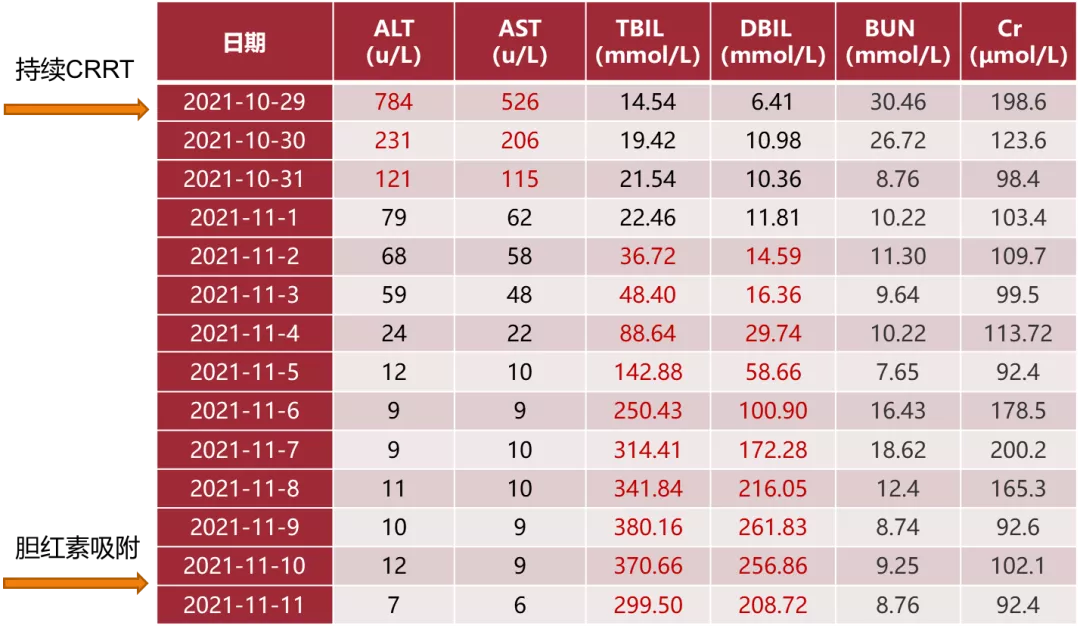
图7:入院后肝肾功能变化
患者同时合并细胞免疫和体液免疫异常,淋巴细胞亚群及绝对计数示CD3+ 234cell/μl ↓,CD3+CD4+ 51cell/μl ↓,CD3+CD8+ 171cell/μl↓,CD4+/CD8+ 0.3,NK计数 86 cell/μl ↓,CD19+B细胞 113 cell/μl。细胞因子示IL-6 6302.1pg/ml↑,IL-8 981.49pg/ml↑ ,IL-10 14.09pg/ml↑,IL-17 85.9pg/ml↑ 。免疫球蛋白及补体示IgG 520mg/dl ↓,IgM 26.1mg/dl ↓,C3 41.4mg/dl ↓,C4 15.70mg/dl ↓。
自身抗体谱、肿瘤标志物未见异常。
入院后治疗
呼吸支持上,10-28给予气管插管+IPPV:PC模式, FiO2 1.0, PC 12cmH2O, PEEP 8cmH2O ,RR12bpm,患者氧合指数持续<60mmHg,收入ICU后尝试俯卧位,氧合指数仍难以改善。10-29 9:00建立VV-ECMO:转速3535rpm,流量4.39-4.59L/min,气流量4L/min,FiO2:1.0;调整 IPPV参数 :PC模式, FiO2 0.35, PC 10cmH2O, PEEP 10cmH2O ,RR12bpm。11-3予床旁经皮气管切开(气管插管<7天)。
抗感染方面
抗病毒:10-29至11-11 奥司他韦 75mg q12h
抗细菌
10-29至11-1 万古霉素 0.5g q8h ,利奈唑胺 600mg q12h 静脉点滴
11-1至11-11 注射用头孢唑林 2g q8h 静脉点滴
10-29至11-3 美罗培南 1g q8h 静脉点滴
11-8至11-11 哌拉西林他唑巴坦 4.5g q8h
预防性抗真菌
10-29至11-11 伏立康唑 200mg q12h 静脉点滴
11-3至11-11 两性霉素B 12.5mg q12h 雾化吸入
抗休克治疗上,入院后积极予液体复苏,去甲肾上腺素等血管活性药物维持MAP 60-65mmHg,最大用量2.2μg/kg/min,持续CRRT。10-29至10-31因患者对血管活性药物反应不佳,予氢化可的松 200mg qd。
抗凝管理上,患者入院时合并凝血功能障碍,在建立ECMO初期,因PT、APTT明显延长,予无肝素/小剂量肝素方案抗凝,在补充新鲜冰冻血浆及集采血小板后,逐渐调定ECMO抗凝目标,在PT、Fib正常基础上,制定APTT目标为55-60s,有效抑制了体外膜肺及管路上血栓形成。
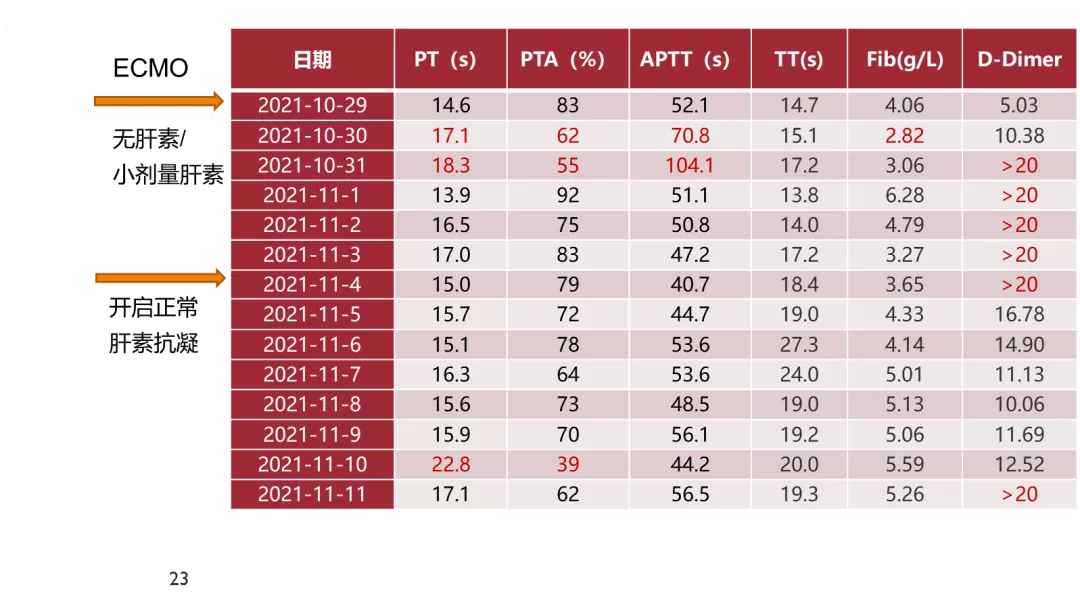
图8:患者凝血功能改善后,逐渐调定ECMO抗凝目标,进行正常肝素抗凝,制定APTT目标为55-60s,D-Dimer水平逐渐降低
评估患者治疗反应
患者氧合无明显改善,11-10复查胸部CT,示肺内实变范围进一步扩大,多发肺内空洞性病变,右侧胸腔积液。行胸腔穿刺,符合化脓性胸腔积液。
图9:复查胸部CT(11-10)
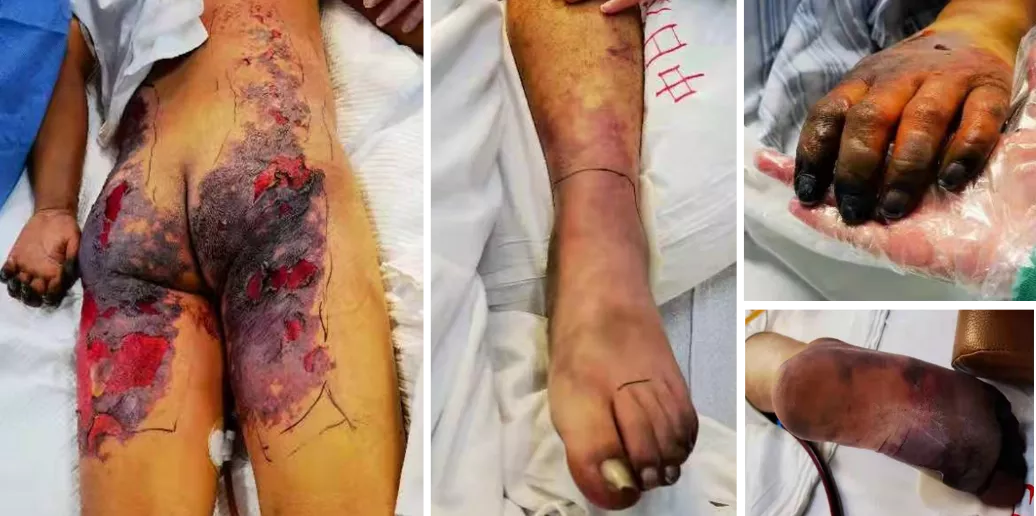
图10:皮肤损害
10-29至11-4 日间唤醒反应不佳,GCS<5分;11-2 间断出现左侧瞳孔对光反射迟钝;11-6呼唤睁眼,双眼向左凝视,结合患者颅脑CT,符合多发脑脓肿合并出血。
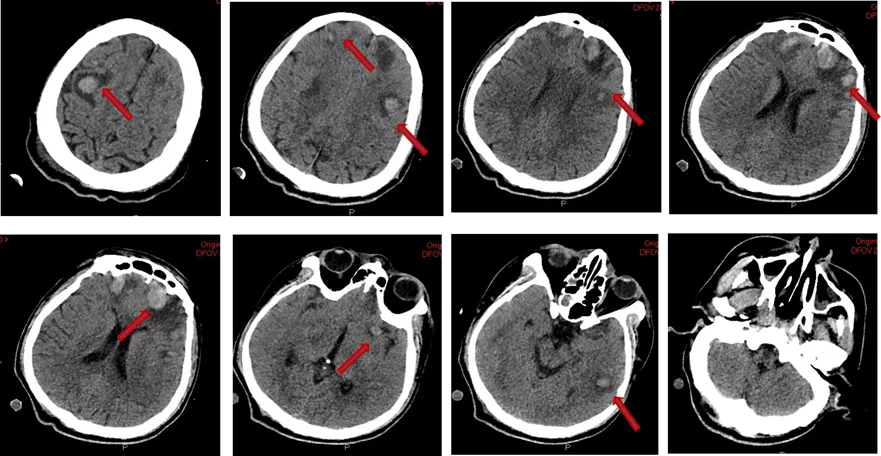
图11:颅脑CT(11-10) ,箭头所示低密度区符合脑脓肿,部分可见高密度出血灶
11-11早查房患者神志改善,心率85-95bpm,BP 115/78mmHg(NE 0.08μg/min/L)。14:05 心率增快>130bpm,血压进行性下降,床旁超声示下腔塌陷,左室乳头肌呈「kiss征」,持续经CVC及PICC快速补液,持续大剂量血管活性药物泵入。18:30 对推注及泵入血管活性药物无反应。22:00 宣布临床死亡。
死亡诊断
患者直接死亡原因为金黄色葡萄球菌播散性感染导致的脓毒性休克。死亡诊断如下:

讨论
Q1:临床上能否尽早识别这类重症流感患者,促进诊断和治疗关口前移,最终挽救患者生命?
张祎:针对这例重症社区获得性肺炎(SCAP)患者,初始的病情评估和选择治疗场所非常重要,但临床研究证实CURB-65和PSI会低估流感病毒肺炎患者病死率,特别是青壮年、无免疫抑制背景者。研究证实氧合指数联合淋巴细胞减低可更好评估流感病毒肺炎患者病死率[1]。还有一些研究,也证实淋巴细胞减低是病毒性肺炎病死率增加的危险因素。该例患者起病初始就表现为低淋巴细胞血症,且在病程中持续[2]。如果我们能在门急诊中将淋巴细胞数量减低作为流感样症状患者病情严重程度的评估指标,可能会对该类患者尽早识别。同时,流感季怀疑流感病毒肺炎患者应,积极进行抗病毒治疗,不必等待病原学结果。重症流感患者如果能早期应用(<48小时)神经氨酸酶抑制剂,较延迟治疗相比(>48小时),可降低患者死亡风险[3]。从结构上分析,神经氨酸酶抑制剂对甲型和乙型流感病毒均具有抗病毒活性。但需警惕新型H1N1甲型流感病毒可能存在对奥司他韦耐药毒株,对奥司他韦治疗无反应或者曾使用奥司他韦预防流感无效的患者,可考虑使用扎那米韦或帕拉米韦替代治疗。在乙型流感中,奥司他韦耐药的数据尚缺乏[4]。
詹庆元教授:在流感流行季节,对怀疑流感病毒感染的SCAP患者,应积极进行流感病毒抗原或者核酸检查,并应积极应用神经氨酸酶抑制剂抗病毒治疗,不必等待流感病原检查结果,重症患者即使发病时间超过48h也推荐应用[5] 。我们应结合患者临床表现对病情严重程度进行评价,影像学上多叶段受累,24-48小时内快速进展,较早出现重力依赖区病变,还有气道分泌物量多,呈现稀薄血性时,都与更重的肺损伤密切相关,可预测患者氧合进行性恶化、常规正压机械通气难以维持,并提示可能需要较长时程ECMO维持。
Q2:患者在外院发热门诊甲乙流抗原快速检测结果为阴性,如何解读?
杨启文教授:通过病毒培养的方式进行流感诊断,因耗时长(>3天),需要专业设备和技术,难以在临床广泛开展,但在鉴别新型流感病毒、明确抗原漂移等方面仍有不可替代的优势[6]。
甲乙流抗原快速检测试剂盒因简单、便捷在门急诊筛查中占有优势,但多种商业检测试剂在监测中存在较大差异,无法进行病毒分型检测。且试剂盒一般采用胶体金方法检测,需要人工判读结果,也导致一定的误差。抗原诊断依赖于口咽、鼻咽部位较高的病毒载量和良好的样本取材,起病初期易出现假阴性,敏感性仅为30-50%[7]。但其阳性预测价值高,在无法开展核酸检测的地区,可作为协助诊断的手段[8]。本例患者流感样症状出现早期即接受抗原快速检测,未获阳性结果,可能受到包括病毒载量低等多因素影响,本病例提示我们抗原检测阴性不能除外流感诊断。
核酸检测已越来越便捷,以其较高的敏感性和特异性,在重症流感中具有重要诊断价值[9]。当临床高度怀疑甲乙流病毒感染时,如甲乙流抗原快速检测为阴性,应尽快完善核酸检测。RT-PCR检测也可对常见的流行株进行鉴别。
由于甲乙流是较为常见的导致CAP的病原微生物,RT-PCT可在个医疗机构常规开展,因此新一代测序在成本和效率上并无优势,不推荐应用于流感病毒的下呼吸道感染诊断。
Q3:为何乙型流感也可造成重症感染?患者是否存在宿主易感因素?
张祎:自2017年以来乙型流感出现了新的流行趋势,重症流感的表现形式也有所变化。乙型流感在人群中传播迅速,感染基数大,虽然重症比例低,但基数较大。相关研究提示,虽然与乙型流感病毒感染者相比,甲型流感住院患者病情更严重,临床改善延迟,但重症乙流也会造成一定的致残和致死[10]。
来源于CAP-China的数据显示,从宿主角度分析,在长期使用糖皮质激素人群中,低淋巴细胞血症预可以预测患者SCAP病死率,其中病毒感染以巨细胞病毒和流感病毒感染最为常见。在免疫抑制宿主中,流感病毒更易合并细菌、真菌感染[11]。
本病例中,患者既往体健,无免疫缺陷证据,分析其快速进展的原因可能与介导病毒免疫相关的基因遗传背景相关。目前研究证实,I型IFN、白介素、趋化因子等在流感病毒感染后产生的防御免疫,极大影响了宿主肺损伤的严重程度。不恰当的「炎症风暴」不仅造成气血屏障严重损伤,还会阻碍有效的获得性免疫,最终导致不良临床结局。相关转化研究证实IFITM3、IRF7、CPTII、SFPA/B等基因多态性与流感病毒感染后预后密切相关[12,13]。遗憾的是,本病例未能从宿主角度开展全外显子测序、全基因组关联研究等后续分析。
詹庆元教授:我们除了从病毒株基因组和宿主基因组等分子生物学角度分析外,在重症流感的救治中还需要密切结合临床表现。早期更重的全身症状(高热等)、较早合并细菌感染(出现黄脓痰)、影像学进展迅速、出现结节晕征等IPA(侵袭性肺曲霉菌病)典型征象、快速氧合恶化、对正压治疗反应不佳等,均是病情危重、预后不良的危险因素。这些征象需要在临床诊疗中早期识别,在重症流感的临床决策中避免延迟插管插管,高危患者及早ECMO干预下实施肺保护性通气,减少气压伤风险,经验性抢先抗细菌及曲霉菌治疗,都是提升重症流感救治能力的关键环节。
Q4:既往临床研究证实在重症流感合并感染的致病微生物中,金黄色葡萄球菌最为常见。结合本例患者,在初始抗生素选择时如何考虑?药敏结果回报为MSSA,应如何调整抗生素?此外,如何评价重症病毒性肺炎中糖皮质激素治疗的价值?
张祎:结合文献报道数据和本中心数据,金黄色葡萄球菌仍是重症流感合并感染中最常见的致病微生物。对1918西班牙大流感期间死亡病例尸体解剖证实,在青霉素发明之前,肺炎链球菌和金黄色葡萄球菌作为上气道定植菌,是继发感染的主要致病菌。随着青霉素制剂和糖肽类抗生素广泛应用,2009年新型H1N1甲型流感流行期间,耐甲氧西林的金黄色葡萄球菌(MRSA)成为住院患者中常见致病菌[14]。因此,在流感季节,该例SCAP患者合并低淋巴细胞血症、影响呈现腺泡填充及融合实变后,我们优先考虑了重症甲型流感合并MRSA肺炎诊断,在抗细菌经验性选择上,我们优先选择指南推荐的万古霉素治疗。同时,患者头颅CT提示鼻窦及副鼻窦炎可能是金黄色葡萄球菌长期定植和慢性感染部位,我们也通过查体、床旁超声等多种手段积极排除了该患者静脉注射、感染性心内膜炎、皮肤软组织感染、人工导管等金黄色葡萄球菌的潜在感染部位。
糖皮质激素在重症流感治疗中未获阳性证据,相反,在新型H1N1甲型流感病毒感染相关ARDS病程早期应用糖皮质激素,与高ICU病死率、高住院病死率及高混合感染风险相关[15]。而RECOVERY研究证实SARS-CoV-2 感染导致的重症肺炎中,地塞米松可降低使用有创呼吸机的患者病死率,但过早应用并不能获益[16]。这说明我们对于病毒,特别是RNA病毒导致的ARDS「炎症风暴」认识还很片面,需要更多转化研究全景解析宿主免疫状态,未来选择合适的亚群、合适的时机、合适的激素剂量,改善患者预后。
詹庆元教授:重症流感患者常合并金黄色葡萄球菌感染,这与流感病毒感染造成的肺泡巨噬细胞耗竭等免疫紊乱状态相关。在抗生素选择上,万古霉素量-效关系稳定,血药浓度监测已广泛开展,ECMO等脏器支持治疗设备对药代动力学影响较小,血药浓度达标即可对MSSA及MRSA感染产生良好治疗效果。利奈唑胺在肺组织内渗透性较好,肺泡衬液药物浓度高,结合本中心近5年对重症流感合并金葡菌感染的救治经验,初始选择了万古霉素与利奈唑胺联合使用。耐酶青霉素与一代头孢类是欧美指南共识一致认为治疗MSSA的「王牌」,因此在抗生素上我们选择了头孢唑啉。在剂量选择上,考虑到患者病情危重,存在AKI、CRRT等对药物清除产生影响的因素,我们选择了较大剂量进行治疗。但目前尚缺乏ECMO对头孢唑啉药代动力学影响的相关报道,我们参照β 内酰胺类抗生素在ECMO实施期间的一般药代规律,未进行给药剂量和频次调整。在重症流感患者中糖皮质激素未获推荐,多个研究证实流感合并IPA者入ICU前应用糖皮质激素者明显高于非IPA者[17]。
杨启文教授:患者最终死亡原因是难治性脓毒性休克,MSSA在足量抗生素治疗情况下,感染仍在播散,实际上社区来源的复杂MSSA感染病死率可高达50%[18]。MSSA与MRSA相比,毒力、侵袭力等相关基因表达更为丰富,通过大量产生内毒素和外毒素造成宿主严重感染,本例患者特征性的粒细胞缺乏及皮肤损害,提示该菌株可能产生产生杀白细胞素及表皮松解毒素等。可以对获得的菌株进行基因组分析,从微生物学角度深层解析该患者临床预后不良的因素。
总结和展望
本次直播分享了一例36岁男性重症流感的诊治过程,从出现流感样症状到入住ICU仅3天,通过气管镜检查入院48小时内明确病原诊断,入院当天接受气管插管、呼吸机辅助通气及体外膜肺支持治疗。虽然经过抗感染、抗休克以及体外膜肺等终极手段在内的脏器支持治疗,仍呈现感染播散,入院2周后死亡。诊断和救治的全程不可谓「不快」,但该例患者救治失败仍带给我们很多启示。
第一,加强对可能转为重症、危重症流感患者的早期识别,临床常用的CAP严重程度评分会低估流感病毒肺炎患者病死率,特别是在中青年人群中,除纳入低淋巴细胞血症等指标外,我们尚需建立更敏感的临床评价体系,实现重症患者诊断和治疗关口前移;
第二,在诊断中,实现重症流感和急性呼吸窘迫综合征两个诊断的融通,这体现了对重症感染性疾病本质的探究和对呼吸病理生理改变的认识,既强调了病原学诊断、抗感染治疗和恢复宿主免疫稳态的价值,又强调了通过正压通气、俯卧位、ECMO等多种呼吸支持手段改善异常的呼吸病生理状态的意义;
第三,我们对重症流感合并/继发感染的认识还有待进一步深化,在现有的临床风险模型基础上进一步完善金黄色葡萄球菌、曲霉菌感染高危因素的认知,为预防性治疗、抢先治疗提供更多循证依据;
第四,流感病毒与宿主免疫细胞相互作用机制并不完全清楚,而COVID-19疫情推动着相关研究发展,未来微生物学家、免疫学家和临床医生都将深入思考重症病毒性肺炎能否在宿主免疫调控方向上寻找新的切入点,包括单细胞测序等技术的发展能更为精准的解析宿主免疫状态,为糖皮质激素、炎症因子或通路的抑制剂等病毒性肺炎治疗中具有临床争议的药物研究提供转化医学证据。
参考文献
[1] Shi SJ et al.Clin Respir J. 2017;11(3):352-360.
[2] Guo LX, et al. Front Microbiol. 2019;10:2752.
[3]Muthuri SG. Lancet Respir Med. 2014 ;2(5):395-404.
[4] Krammer F, et al. Nat Rev Dis Primers. 2018;4(1):3.
[5]中国成人社区获得性肺炎诊断和治疗指南(2016年版).中华结核和呼吸杂志.2016.39(4):1-27.
[6] Matthey S, et al. J Clin Microbiol. 1992; 30, 540–544.
[7] Hurt AC, et al. J Clin Virol. 2007; 39, 132–135.
[8] Swati K, et al. Clin Microbiol Rev. 2012; 25(2): 344–361.
[9] Loeffelholz, MJ, et al. J Clin Microbiol.2011,49:4083–4088.
[10] Wang Y, et al. Open Forum Infect Dis. 2019. 6(3): ofz053.
[11]李丽娟 等.中华医学杂志, 2018; 98 (10): 738-743
[12]Everitt AR, et al. Nature. 2012; 484:519–23
[13]Adam DK, et al. Annu Rev Genet. 2017; 51: 241–263.
[14] Richard GW, et al.Infect Dis Clin N Am.2013;27:177–188
[15] Joost W, et al. Intensive Care Med. 2012; 38(11):1761–1768
[16]RECOVERY Collaborative Group. N Engl J Med. 2021;384(8):693-704.
[17]Vanderbeke L, et al. Curr Opin Infect Dis. 2018;31(6):471-480.
[18]De la Calle C, et al. Eur J Clin Microbiol Infect Dis. 2016;35(3):497-502.
作者介绍

张祎
2013年获得博士学位,主治医师,2018年PCCM专培项目结业。从事呼吸危重症临床工作。研究方向:,针对重症患者急慢性呼吸衰竭的救治开展多项临床研究,参与“急性肺损伤后炎症调控与组织修复机制”研究工作。承担国家自然基金项目1项,参与国自然面上项目、十三五国家重点研发计划等多项国家级项目。发表SCl、核心期刊论文多篇。学术兼职:担任中国生物化学与分子生物学会脂质与脂蛋白专业委员会青年委员。

杨启文
研究员,北京协和医学院医学博士,硕士生导师。北京协和医院检验科副主任;欧洲临床微生物和感染病学会药敏委员会华人抗菌药物敏感性试验委员会(ChiCAST)秘书长、副主任委员;中国医师协会检验医师分会青年委员会副主任委员;中华医学会细菌感染与耐药防治分会青年学组副组长;国家卫健委抗菌药物临床应用与细菌耐药评价专家委员会委员;北京中西医结合学会检验医学专业委员会副主任委员;2004年至今在北京协和医院检验科工作,主持和参与包括国家自然科学基金、国家863计划在内的70余项科研课题。目前在国内外杂志发表论文超百篇,以第一作者和通讯作者发表SCI文章50余篇,包括Clin Infect Dis,EMERG MICROBES INFEC,J ANTIMICROB CHEMOTH,Clin Transl Med等感染和微生物领域权威杂志。授权专利4项。以主要完成人获得高等学校科技进步奖二等奖1项、中华预防医学会科技奖二等奖1项、北京市科技奖二等奖1项、中华医学科技奖三等奖2项、华夏医学科技奖三等奖1项、中华医学会分会奖7项,北京青年学术演讲比赛优秀奖一项,2011年度“中国百篇最具影响国内学术论文”,2013年度中国精品科技期刊顶尖学术论文(领跑者5000)。

詹庆元
博士研究生导师,中日医院呼吸与危重症医学科四部与五部主任。中国医师协会内科医师协会副会长,中国医师协会呼吸医师分会危重症医学工作委员会主任委员,中国医师学会重症医师专业委员会常委。教育部人才项目特聘教授,“百千万人才工程”国家级人选,有突出贡献中青年专家,全国杰出专业技术人才。
* 感谢赛沛(上海)商贸有限公司对本次直播的大力支持!