
摘要
新型冠状病毒感染(coronavirus disease 2019,COVID-19)在世界范围内流行,然而目前对于如何管理间质性肺疾病(interstitial lung disease,ILD)合并COVID-19患者的临床认识非常有限。另一方面,急性COVID-19后发生的ILD(post-acute covid-19 ILD,PC-ILD)也很常见,如何规范管理也是临床面临的问题。为此,中国研究型医院学会呼吸分会邀请国内ILD领域专家组成共识编写组,充分收集临床意见,基于临床收集问题,组织专家讨论,最终确定纳入了22个问题,主要包括ILD合并COVID-19患者临床特征、重症/死亡风险和风险因素、治疗管理、PC-ILD临床特征、风险因素和治疗等方面。基于国内外指南、临床研究数据等证据,经过多次讨论和投票表决,形成15条推荐意见,共同制定了《新型冠状病毒感染疫情下间质性肺疾病患者临床管理中国专家共识》,旨在提升对ILD合并COVID-19以及PC-ILD的认识,为临床决策提供依据,提高临床救治水平。
推荐意见1:新冠肺炎与急性/亚急性起病的ILD建议从暴露史、症状体征、肺高分辨率CT(HRCT)特征、实验室检查5个方面鉴别。
推荐意见2:参考新型冠状病毒感染诊疗方案(试行第十版),对ILD合并COVID-19疾病严重程度分级及管理。
推荐意见3:ILD是COVID-19重症/危重症独立危险因素,ILD合并COVID-19患者应尽早进行抗病毒治疗,最佳使用时机为出现症状5 d以内。
推荐意见4:基础ILD无激素治疗指征者急性COVID-19时激素使用遵照COVID-19激素使用原则。基础ILD需开始或已使用激素者出现急性COVID-19时可继续使用激素,剂量调整依据基础ILD和COVID-19病情需要:重型/危重型ILD合并COVID-19但不符合SARS-Cov-2 触发AE-ILD者激素使用遵照重型/危重型COVID-19使用原则;符合AE-ILD者按AE-ILD处理。
推荐意见5:IL-6抑制剂在COVID-19合并ILD人群中的使用尚无针对此类人群的临床研究证据,建议参照一般COVID-19患者使用原则。
推荐意见6:JAK抑制剂在COVID-19合并ILD患者中的使用也无针对此类人群的临床研究证据,建议参照一般COVID-19患者使用原则。
推荐意见7:对于出现COVID-19时尚未使用免疫抑制剂/生物制剂的ILD患者,若短期ILD进展的可能性低,可适当延迟启动免疫抑制剂/生物制剂治疗至COVID-19急性期后。对于已使用免疫抑制剂/生物制剂患者,建议采取多学科讨论方式,与风湿免疫科医生共同讨论,根据个体评估结果,权衡免疫抑制剂继续使用的获益和风险,COVID-19急性期可暂停免疫抑制剂,除非短期停用影响基础ILD或结缔组织疾病病情控制。
推荐意见8:基础ILD使用抗纤维化药物者出现COVID-19时应继续使用抗纤维化药物,对于新诊断的纤维化性ILD需要使用抗纤维化药物的患者,建议及早启动抗纤维化治疗。
推荐意见9:ILD合并COVID-19患者应积极进行病原学检查监测合并和(或)继发感染,及时应用抗感染药物预防或治疗细菌、真菌、耶氏肺孢子菌、巨细胞病毒等感染。
推荐意见10:ILD合并COVID-19患者抗凝治疗建议按照一般患者原则使用。
推荐意见11:在起病后(未住院患者)或出院后(住院患者)4周时随访。若病情稳定,可参照普通ILD患者诊疗常规,每3~6个月随访1次。胸部HRCT和肺功能是常规随访项目。动脉血气分析、心脏超声、CT肺动脉造影、血液学检查根据患者病情需要酌情选择。
推荐意见12:胸部CT明显异常、肺功能受损严重的重型/危重型COVID-19患者,是康复干预的主要目标人群。康复治疗应遵循个体化治疗原则。
推荐意见13:医务工作者和疫苗接种人员应让患者充分知情接种疫苗的获益及风险,并与患者共同讨论决策是否接种疫苗。
推荐意见14:对于急性COVID-19后仍有持续或进展的呼吸道症状,肺间质病变范围仍较大者,在排除感染等其他病因后可加用激素治疗。
推荐意见15:重症/危重症COVID-19后PC-ILD患者可加用抗纤维化药物治疗,但需要基于纤维样病变的范围、药物副作用、超适应症用药等问题,与患者协商后个体化决定。用药最佳时机、疗程尚不确定。对于轻、中型COVID-19后患者不倾向加用抗肺纤维化药物,可随访监测,基础存在纤维化性ILD患者除外。
截至2022年12月,已有超过6.42亿例新型冠状病毒感染(coronavirus disease 2019,COVID-19)确诊病例,该流行病已夺去约662万人的生命[1]。而在2022年12月下旬我国也经历了一轮COVID-19流行高峰。间质性肺疾病(interstitial lung disease,ILD)是一大类以肺间质、肺泡慢性炎症和纤维化为主要病理特征的弥漫性肺疾病,很多ILD患者长期接受免疫抑制治疗。对于ILD合并COVID-19患者的临床如何管理目前认识非常有限。另一方面,急性COVID-19后发生的ILD(post-acute Covid-19 ILD,PC-ILD)也很常见。为此,我们邀请国内ILD领域专家组成共识编写组,充分收集临床意见,基于国内外指南、临床研究数据,经过多次讨论,共同制定了《新型冠状病毒感染疫情下间质性肺疾病患者临床管理中国专家共识》(以下简称“共识”),旨在提升对ILD合并COVID-19以及PC-ILD的认识,为临床决策提供依据,提高临床救治水平。
编写组基于临床收集问题,组织专家讨论,最终确定纳入了22个问题,主要包括ILD合并COVID-19患者临床特征、重症/死亡风险和风险因素、治疗管理、PC-ILD临床特征、风险因素和治疗等方面。其中涉及诊断和治疗的部分内容,参考了分级的评估、制定和评价(GRADE)方法和牛津循证医学中心2011年的证据等级标准(OCEBM 2011版),对证据进行分级,详细证据列表可通过本文附件下载。证据质量分为“高、中、低和极低”4个等级,分别用A~D表示(附录表1)。推荐意见根据GRADE方法分为“强、弱”2个级别,分别用1和2表示(附录表2)。所有推荐意见通过Delphi法进行投票表决。推荐或反对某一措施至少需要获得50%的参与者认可,且持相反意见的参与者比例需低于20%,未满足此项标准将不产生推荐意见。最终形成15条推荐意见,任何一条推荐意见被列为强推荐而非弱推荐,需要得到至少80%的参与者认可。所有参与本共识的专家成员均已签署书面利益声明,与医药企业不存在利益关系。


一、ILD合并COVID-19临床特征
COVID-19流行早期统计数据显示COVID-19患者中基础存在ILD患者比例约为1%~2%[2, 3]。COVID-19对基础存在ILD患者可能出现多种临床表现:(1)ILD患者发生新型冠状病毒肺炎(以下简称新冠肺炎);(2)ILD患者感染新型冠状病毒(SARS-CoV-2)后诱发ILD急性加重(acute exacerbation of interstitial lung disease,AE-ILD),出现SARS-Cov-2病毒触发的AE-ILD。(3)COVID-19急性期后在基础ILD上叠加PC-ILD,如机化性肺炎(organizing pneumonia,OP)、非特异性间质性肺炎(nonspecific interstitial pneumonitis,NSIP)表现;(4)COVID-19急性期后诱发患者基础ILD病情活动或进展。
【问题1】ILD合并COVID-19患者临床特征与非ILD COVID-19患者有无差异?
ILD合并COVID-19患者主要症状如发热、畏寒、肌痛、恶心、呕吐、头晕等与非ILD患者相比差异,但ILD患者更易出现咳嗽、咳痰、呼吸困难等呼吸道症状[4, 5]。肺部影像学上新冠病毒肺炎表现也与非ILD患者无差异,但ILD患者影像学上还存在基础ILD影像表现。实验室检查方面,ILD合并COVID-19患者外周血淋巴细胞数、淋巴细胞亚群、C反应蛋白、红细胞沉降率、乳酸脱氢酶、铁蛋白等与非ILD患者比也未发现差异,有研究发现中性粒细胞计数、单核细胞计数、IL-8、IL-10、IL-1β和D-二聚体在ILD患者中更高[4](证据列表1,证据等级D)。
二、新冠肺炎和ILD鉴别
新冠肺炎影像学表现可出现磨玻璃影、铺路石征、实变影、线网状影等多种肺泡及间质受累病变,与急性/亚急性起病的ILD相似。诊断新冠肺炎要注意与呈现急性/亚急性病程的ILD鉴别,以免误诊、漏诊。
【推荐意见1】新冠肺炎与急性/亚急性起病的ILD建议从暴露史、症状体征、肺高分辨率CT(HRCT)特征、实验室检查5个方面鉴别(表1)。1C,证据列表2,40票赞成,0票反对,1票弃权。


新冠肺炎根据病程和胸部影像学表现通常可分为4期:早期(起病1周内,以SARS-CoV2抗原或核酸阳性或出现症状日为起点):磨玻璃影为主,可见铺路石征;进展期(起病1~2周):病变范围增大,密度较前升高,可见中心实变影、结节、晕征;高峰期(起病2周左右):病变范围变化不大,密度进一步升高,实变为主,磨玻璃影、线网状影等混合存在;部分患者在进展期迅速进入重症期,出现弥漫性肺泡损伤(diffuse alveolar damage,DAD)表现;吸收期(起病2~3周后):病变范围开始缩小、密度减低,磨玻璃影、线网状影为主[6, 7, 8, 9]。两期之间影像学可有重叠,不同个体、不同疾病严重程度各期持续时间可有差异。把握住新冠肺炎病程和影像上随时间演变和分期特点对于鉴别诊断至关重要。
值得注意的是,文献报道在新冠肺炎住院患者中出现至少一种自身抗体阳性比例可达45%~57%[10, 11, 12, 13],要注意与结缔组织疾病相关ILD(connective tissue disease-associated ILD,CTD-ILD)鉴别。其中常见为类风湿因子滴度升高,抗核抗体(ANA)阳性(≥1∶160),还可见抗Scl-70/TOPO1、抗RIG1、抗MDA5、或抗MJ/NXP2等抗病毒信号抗原的自身抗体,抗 52 kDa SSA/Ro、抗60KDa SSA/Ro阳性、抗PM-SCL阳性、抗Jo-1抗体或抗磷脂抗体谱阳性,但ANCA阳性和其他自身抗体阳性少见。这些自身抗体阳性大多见于重症/危重症新冠肺炎患者患者[11, 12, 13]。
三、ILD合并COVID-19发生重症和(或)死亡的风险及相关危险因素
【问题2】ILD合并COVID-19患者发生重症和(或)死亡风险与非ILD患者有差异吗?
ILD合并COVID-19患者预后明显差于无ILD基础病者。2020年至2021年COVID-19流行期间研究数据显示:ILD患者感染SARS-COV2后约52%~84%住院,约10.8%~35.6%入住ICU,约11.9%~22.2%机械通气[3,5,14, 15],总病死率较同期临床匹配非ILD COVID-19患者明显升高(13.4% vs. 2.8%[3],33% vs. 13%[16],15.94% vs. 11.16%[14]),住院的ILD患者院内病死率也明显高于匹配的非ILD COVID-19住院患者(39.29% vs. 15.38%[4],49% vs. 35%[17])。ILD患者合并新冠病毒感染后出现重症风险更高(OR值为1.34~2.73),死亡风险更高[2, 3,14,16, 17, 18, 19](OR值为1.2~4.3,证据列表3,证据等级B)。

【问题3】ILD合并COVID-19发生重症和(或)死亡的危险因素有哪些?
ILD合并COVID-19发生重症和(或)死亡的危险因素包括:(1)高龄、男性、肥胖、多种合并症如高血压、糖尿病、缺血性心脏病、恶性肿瘤、血液系统肿瘤等、未完全接种疫苗等,这些同时也是COVID-19的重症和(或)死亡的危险因素。(2)基础ILD严重程度:基础肺功能受损的ILD患者(FVC占预计值%<80%)生存率明显差于FVC正常者(HR值为1.72)[17],低DLCO、需长期家庭氧疗也可能与病死率相关[5]。(3)基础ILD诊断:不同基础ILD种类合并COVID-19后出现重症和(或)死亡风险不同。以非ILD患者为对照,IPF患者具有最高的重症风险(OR值为14.82),CTD-ILD未观察到重症风险升高的趋势(OR值为1.11)[3,17]。但也有研究发现CTD-ILD中SSc-ILD与出现中重度COVID19风险相关(OR值为2.73)[19],RA-ILD患者合并COVID-19院内病死率也显著高于非ILD患者[17]。纤维化性特发性间质性肺炎患者 感染COVID-19后30 d和60 d病死率显著高于CTD-ILD和结节病等其他ILD患者[15]。肺结节病合并COVID-19与年龄、合并症等匹配对照人群相比病死率无差异[20]。这些研究结果提示,纤维化性特发性间质性肺炎具有较高的重症和(或)死亡风险,而结节病、非纤维化性CTD-ILD可能较非ILD人群略升高或无差异。虽然长期使用糖皮质激素(以下简称激素)或其他免疫抑制药物被列为COVID-19重型/危重型危险因素,但值得注意的是,多个研究均未证实ILD患者长期应用免疫抑制治疗与COVID-19住院风险、病死率相关[15, 16, 17,19,21](证据列表4,证据等级B)。
四、ILD合并COVID-19 患者的管理
1.ILD合并COVID-19疾病严重程度分级和分级管理。
【问题4】ILD合并COVID-19如何对疾病严重程度分级和分级管理?
【推荐意见2】参考新型冠状病毒感染诊疗方案(试行第十版)[22],对ILD合并COVID-19疾病严重程度分级及管理见表2(1D,证据列表5,41票赞成,0票反对,0票弃权)。
2. ILD合并COVID-19的药物治疗:(1)抗病毒药物。
【问题5】ILD合并COVID-19抗病毒药物如何应用?
【推荐意见3】ILD是COVID-19重症/危重症独立危险因素,ILD合并COVID-19患者应尽早进行抗病毒治疗,最佳使用时机为出现症状5 d以内[23](1D,证据列表6,40票赞成,0票反对,1票弃权)。
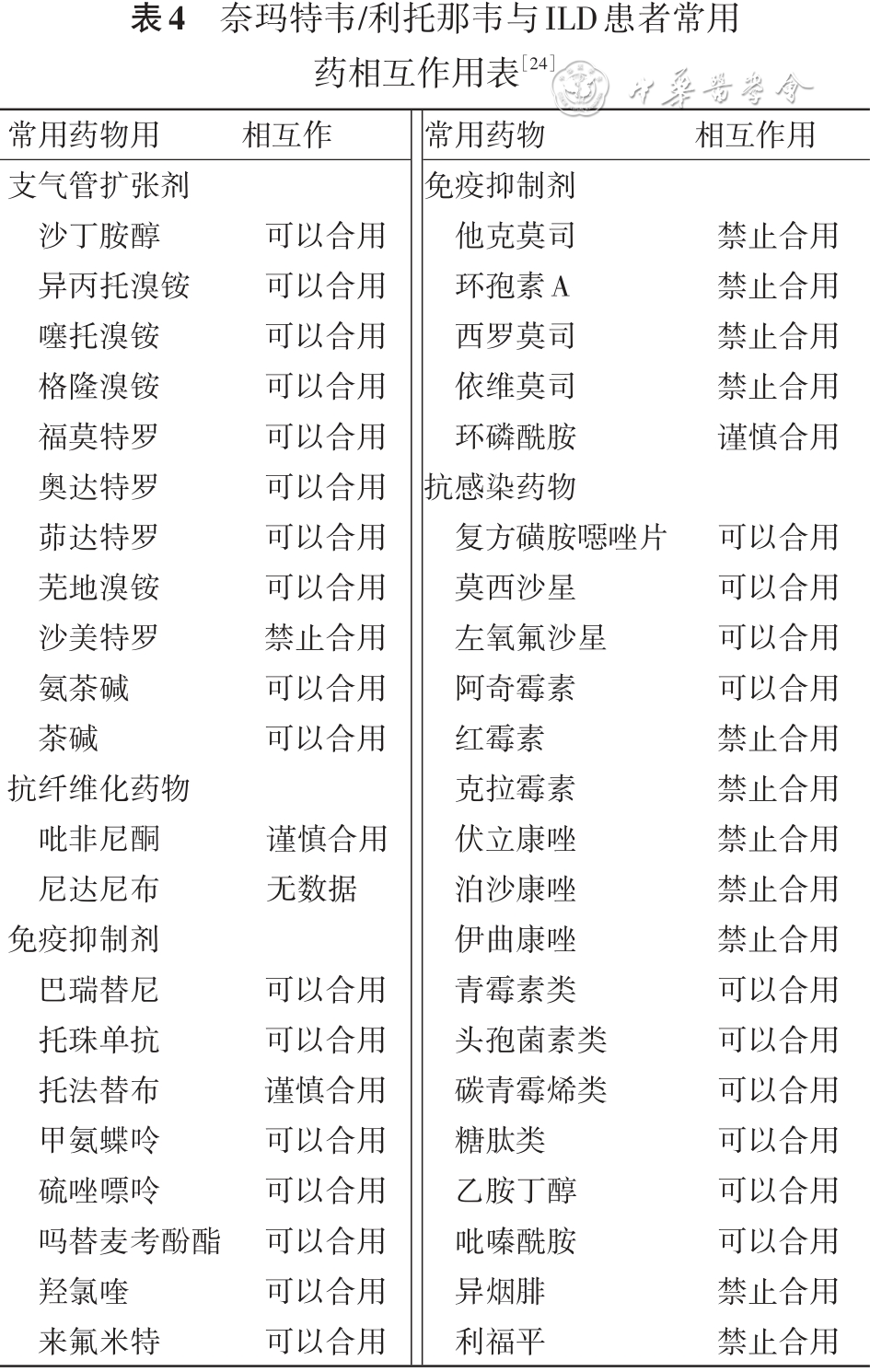
目前国内常用的抗病毒药物及用法用量等具体事项见表3,使用前需要注意ILD患者常用药物与抗病毒药物相互作用见表4[24]。
(2)免疫调节药物。
【问题6】ILD患者COVID-19急性期如何使用激素?
【推荐意见4】基础ILD无激素治疗指征者急性COVID-19时激素使用遵照COVID-19激素使用原则。基础ILD需开始或已使用激素者出现急性COVID-19时可继续使用激素,剂量调整依据基础ILD和COVID-19病情需要:重型/危重型ILD合并COVID-19但不符合SARS-Cov-2 触发AE-ILD者激素使用遵照重型/危重型COVID-19使用原则;符合AE-ILD者按AE-ILD处理(图1,2D,证据列表7,39票赞成,1票反对,1票弃权)。
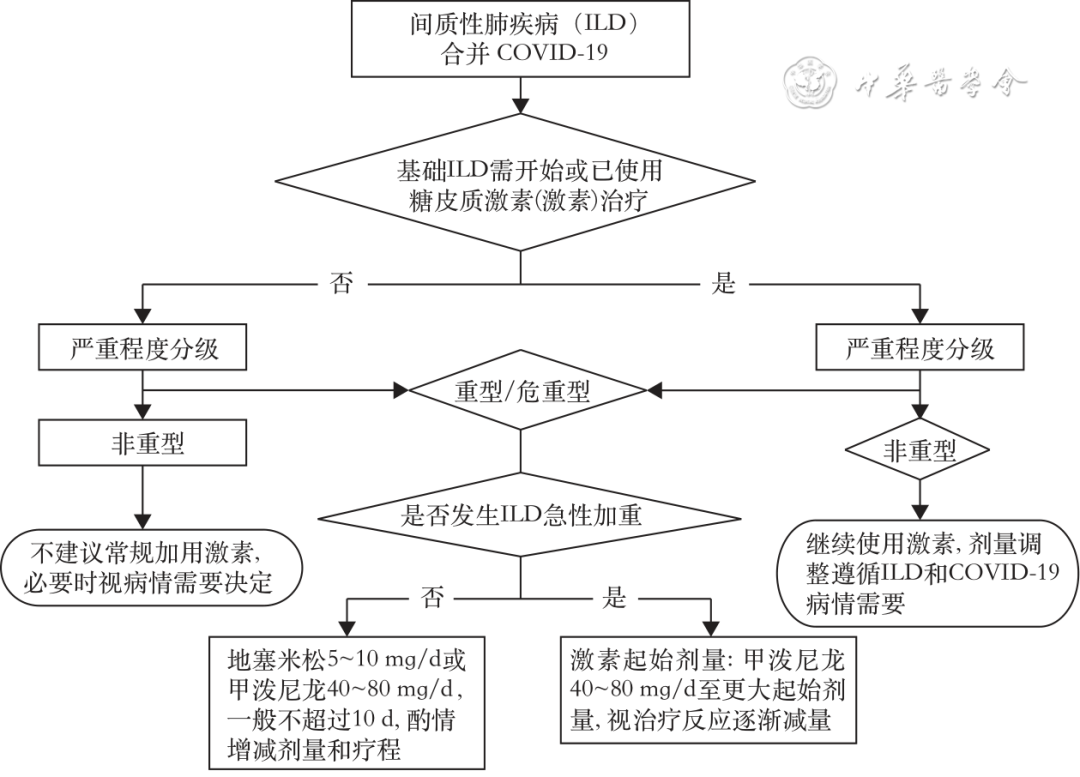
图1 ILD合并COVID-19感染期糖皮质激素使用建议
基础ILD无激素治疗指征者急性COVID-19时激素使用遵照COVID-19激素使用原则,非重型不建议常规加用激素[23],必要时由主诊医师根据患者具体情况决定。重型/危重型COVID-19使用原则[23]:地塞米松 5~10 mg/d,也可选用等效剂量其他激素,如甲泼尼龙、泼尼松或氢化考的松,一般不超过 10 d,建议综合患者COVID-19病程、严重程度、影像特点和范围、基础合并症等因素决定激素的剂型、剂量、用法、疗程,可酌情增量、减量或延长疗程。AE-ILD处理原则[25]:甲泼尼龙起始剂量可从40~80 mg/d至更大起始剂量,根据病情严重程度而定,然后逐渐减为泼尼松0.5~1 mg·kg-1·d-1或等效剂量激素,对激素治疗有效的患者,在数周到数月内缓慢减量,并且要密切随访,防止复发,密切监测和处理激素不良反应。AE-ILD定义为:(1)既往或当前诊断为ILD;(2)通常在1个月内发生的呼吸困难急性恶化或进展;(3)肺HRCT表现为在原来ILD表现背景上新出现双肺弥漫性磨玻璃影和(或)实变影;(4)排除心力衰竭或液体负荷过重[26]。
【问题7】ILD患者COVID-19急性期IL-6抑制剂如何使用?
【推荐意见5】IL-6抑制剂在COVID-19合并ILD人群中的使用尚无针对此类人群的临床研究证据,建议参照一般COVID-19患者使用原则(2D,证据列表8,38票赞成,0票反对,3票弃权)。
一般COVID-19患者急性期IL-6抑制剂使用指征为新冠肺炎需要高流量氧疗或更强呼吸支持;或已启用激素治疗但仍需升级吸氧条件,炎症指标明显升高如C反应蛋白>75 mg/L者[27, 28]。一般在住院 96 h内,或者接受 ICU 级别治疗的 24~48 h内使用,与激素联用,通常为单次使用,8 mg/kg,单次最大剂量不超过800 mg,必要时评价再次用药,但不超过 2 次[23](1D,证据列表7)。相对禁忌征:对托珠单抗过敏、存在活动性感染、既往憩室炎或肠溃疡、病毒性肝炎、中性粒细胞计数<1 000/μl,血小板计数<50 000/μl、谷丙转氨酶>3 倍正常上限、中重度肾功能损伤。
【问题8】ILD患者COVID-19急性期JAK抑制剂如何使用?
【推荐意见6】JAK抑制剂在COVID-19合并ILD患者中的使用也无针对此类人群的临床研究证据,建议参照一般COVID-19患者使用原则(2D,证据列表9,39票赞成,0票反对,2票弃权)。
COVID-19患者JAK 抑制剂应用指征与 IL-6 拮抗剂类似,与激素联用,巴瑞替尼4 mg 口服给药,1次/d,总疗程14 d或直至出院[23]。如果巴瑞替尼不可获得,可用托法替布 10 mg口服给药,2次/d,应用14 d或直至出院[27, 28]。相对禁忌:对JAK抑制剂过敏、存在活动性感染、既往憩室炎、病毒性肝炎、中性粒细胞计数<1 000/μl、淋巴细胞计数<200/μl,血红蛋白<80 g/L、重度肝功能损伤、肌酐清除率<30 ml/min。
【问题9】ILD基础免疫抑制剂/生物制剂COVID-19急性期如何调整?
【推荐意见7】对于出现COVID-19时尚未使用免疫抑制剂/生物制剂的患者,若短期ILD进展的可能性低,可适当延迟启动免疫抑制剂/生物制剂治疗至COVID-19急性期后。对于已使用基础免疫抑制剂/生物制剂患者,建议采取多学科讨论方式,与风湿免疫科医生共同讨论,根据个体评估结果,权衡免疫抑制剂继续使用的获益和风险,COVID-19急性期可暂停免疫抑制剂,除非短期停用影响基础ILD或结缔组织疾病病情控制(2C,证据列表10,38票赞成,2票反对,1票弃权)。
免疫抑制剂/生物制剂为部分ILD患者的基础治疗,其对COVID-19预后的影响尚不确定,COVID-19急性期是否继续使用目前循证医学证据有限。基础ILD使用免疫抑制剂/生物制剂者COVID-19感染期是否继续使用或停用基于两个相互矛盾方面的权衡:(1)现有研究未发现ILD免疫抑制背景治疗会增加COVID-19严重度、住院或死亡风险[15, 16, 17,19,21],可能与其可削弱细胞因子风暴(可导致COVID-19不良结局)相关。此外停用基础ILD治疗后ILD活动也可能会增加COVID-19不良结局风险。(2)大多数免疫抑制剂在COVID-19感染期可能会延迟对病毒的清除,增加继发或合并感染风险,还可能与抗病毒药物等COVID-19治疗药物出现药物相互作用,增加肝肾损害风险。对于出现COVID-19时尚未使用免疫抑制剂/生物制剂的患者,若短期ILD进展的可能性低,可适当延迟启动免疫抑制剂/生物制剂治疗至COVID-19急性期后。而对于已接受免疫抑制剂/生物制剂治疗的ILD患者,美国学者建议维持原治疗或至少低剂量的免疫调节治疗[29],英国的NICE指南则建议考虑暂停免疫抑制剂,除非原发病加重的风险超过停止治疗的获益[30]。
【问题10】基础ILD抗纤维化药物COVID-19急性期如何调整?
【推荐意见8】基础ILD使用抗纤维化药物者出现COVID-19时应继续使用抗纤维化药物,对于新诊断的纤维化性ILD需要使用抗纤维化药物的患者,建议及早启动抗纤维化治疗[29, 30](1D,证据列表11,41票赞成,0票反对,0票弃权)。
但抗纤维化药物的不良反应如腹泻、皮疹、恶心呕吐、肝功能损伤等与COVID-19的部分症状存在重叠,可能加重COVID-19症状[29,31]。此外,抗纤维化药物还可能存在与其他治疗药物相互作用导致不良反应增加的风险,对于ILD合并COVID-19的患者进行抗纤维化治疗应密切关注药物副作用以及时调整剂量或停药。
【问题11】ILD合并COVID-19患者其他抗感染药物如何使用?
【推荐意见9】ILD合并COVID-19患者应积极进行病原学检查,监测合并感染和(或)继发感染,及时应用抗感染药物预防或治疗细菌、真菌、耶氏肺孢子菌、巨细胞病毒等感染(1B,证据列表12,41票赞成,0票反对,0票弃权)。
首次就诊的新冠感染普通人群较少合并细菌感染,住院的COVID-19人群合并细菌感染或合并其他病毒感染发生率有报道约为2.5%~5.1%[32, 33],而治疗中随着病程延长继发细菌感染或真菌感染发生率可达15%左右[32],重症患者中发病率更高,可达41.9%[33]。而且ILD患者存在肺纤维化、蜂窝肺、牵张性支气管扩张等基础肺结构异常,以及长期免疫抑制治疗,因此ILD合并COVID-19患者应高度警惕合并或继发细菌、真菌、耶氏肺孢子菌、巨细胞病毒感染的风险,积极进行病原学检查及监测,及时应用抗感染药物预防或治疗细菌、真菌、耶氏肺孢子菌、巨细胞病毒等感染。
【问题12】ILD合并COVID-19患者抗凝药物如何使用?
【推荐意见10】ILD合并COVID-19患者抗凝治疗建议按照一般患者原则使用(1D,证据列表13,40票赞成,0票反对,1票弃权)。
一般COVID-19患者抗凝药物使用原则为对住院治疗的中型、重型/危重型COVID-19患者无抗凝治疗禁忌者应接受预防剂量低分子肝素或肝素抗凝(低分子肝素3 000~4 000 U、1次/d皮下注射),有其他需要治疗剂量抗凝指征者给予治疗剂量抗凝[27, 28]。需要治疗剂量抗凝指征为:(1)需低流量氧疗、不需入住ICU的成年非妊娠患者,若D-二聚体水平明显升高、无额外出血风险者;(2)已发生静脉血栓栓塞事件者;(3)患COVID-19前因基础疾病应用抗凝治疗者,除非有禁忌,应继续应用。抗凝治疗禁忌征[28]:(1)治疗剂量肝素抗凝的禁忌证包括血小板<50×109/L、血红蛋白<80 g/L、需双联抗血小板治疗、既往30 d内因出血需急诊就诊、出血性疾病病史、遗传性或活动性获得性出血性疾病、严重肾功能不全;(2)预防剂量肝素抗凝的禁忌证包括近期中枢神经系统出血、活动性大出血且24 h内输血>2个单位、血小板<50×109/L、严重肾功能不全。需注意避免同时应用内皮生长因子(VEGF)酪氨酸激酶受体抑制剂如尼达尼布和抗凝药物。
3. ILD合并COVID-19患者的随访与康复。
【问题13】ILD合并COVID-19患者COVID-19急性期后如何随访?
【推荐意见11】在起病后(未住院患者)或出院后(住院患者)4周时随访。若病情稳定,可参照普通ILD患者诊疗常规,每3~6个月随访1次(2D,41票赞成,0票反对,0票弃权)。胸部HRCT和肺功能是常规随访项目。动脉血气分析、心脏超声、CT肺动脉造影、血液学检查根据患者病情需要酌情选择(1D,41票赞成,0票反对,0票弃权)。
【问题14】ILD合并COVID-19患者COVID-19急性期后如何康复治疗?
【推荐意见12】胸部CT明显异常、肺功能受损严重的重型/危重型COVID-19患者,是康复干预的主要目标人群。康复治疗应遵循个体化治疗原则(1B,证据列表14,41票赞成,0票反对,0票弃权)。
胸部CT明显异常、肺功能受损严重的重型/危重型COVID-19患者,是康复干预的主要目标人群[34]。研究显示呼吸训练、咳嗽排痰训练、膈肌训练、拉伸运动和家庭运动等在内的肺康复训练有助于改善ILD患者(包括重症COVID-19急性期后患者)的肺功能、运动能力和与健康相关的生存质量[35]。呼吸康复治疗是减少和预防相关肺部并发症的经济有效、简单方便的方法,康复治疗应遵循个体化治疗原则。
4. ILD患者新冠疫苗接种。
【问题15】ILD患者接种新冠疫苗有何建议和注意事项?
【推荐意见13】医务工作者和疫苗接种人员应让患者充分知情接种疫苗的获益及风险,并与患者共同讨论决策是否接种疫苗(1C,证据列表15,36票赞成,1票反对,4票弃权)。
由于ILD患者是COVID-19重症/危重症风险人群,且新冠疫苗接种可降低ILD患者感染新型冠状病毒以及发展成重症感染的风险[36],尽管目前有新冠病毒疫苗可引起AE-ILD的病例报道[37, 38, 39]和引起基础自身免疫性和炎症型风湿病复发或加重的风险[40],但整体发生率低,文献报道不到1%[37],总体来说ILD人群从疫苗中获益大于风险。因此医务工作者和疫苗接种人员应让患者充分知情接种疫苗的获益及风险,并与患者共同讨论决策是否接种疫苗。接种新冠病毒疫苗的禁忌证参考我国《新型病毒疫苗接种技术指南(第一版)》[41]。而针对正在接受免疫抑制治疗的CTD-ILD患者,具体疫苗接种事项参见美国风湿病学会《风湿和肌肉骨骼疾病患者COVID-19疫苗接种指南》[40] 和《特殊人群(慢性肝病、结核病和风湿免疫病患者)新型冠状病毒疫苗接种专家建议》[42]。
五、PC-ILD
1. PC-ILD 定义、临床特征及演变。
【问题16】PC-ILD 定义、常见影像及演变情况如何?
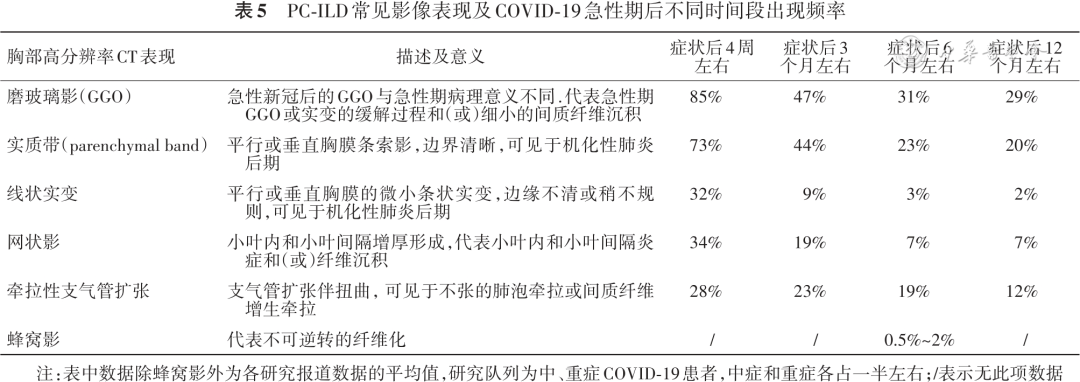
急性COVID-19通常指从出现SARS-CoV-2感染症状至4周以内,因为3周后通常不能分离到具有复制能力的活病毒[43]。部分患者在急性COVID-19后仍存在持续或进展的呼吸道症状,肺HRCT上仍可见一定范围的肺间质病变影像,组织病理上表现为慢性炎症和(或)纤维组织增生,出现急性COVID-19后ILD(PC-ILD)。
PC-ILD非常常见,中重度COVID-19患者出院时平均85%患者肺HRCT可见磨玻璃影,73%可见实质带,30%可见网状影、线状实变或支气管扭曲/扩张。大部分患者随时间推移病变可完全消退,症状后3个月左右50%~60%完全消退,6个月左右60%~70%,12个月左右75%[34,44, 45, 46, 47, 48](表5)。病变范围也随时间推移逐渐缩小[34,45,49, 50, 51]。病变消退主要在症状后6个月以内,6个月后残留病变消退较慢或持续存在,罕见遗留蜂窝影[50, 51],并可能与先前存在的纤维化性ILD相关[52, 53],或与患者自身存在损伤修复异常等生理基础相关。急性炎症损伤后修复情况下出现的成纤维细胞增生和(或)胶原沉积导致胸部影像上出现纤维样病变(实质带、线状实变、网状影、支气管扩张/扭曲)与慢性纤维化意义完全不同,并不意味着进行性发展,通常可部分吸收或稳定。因此在描述新冠后肺间质异常表现时应慎重使用“纤维网格影”“蜂窝影”“纤维化”等通常提示不可逆转或进行性肺纤维化相关的描述术语,建议使用“网状影”“纤维样病变”等术语[54]。需要注意的是这些数据主要来自于2020年感染早期毒株人群,不同研究间数据差异大,研究队列中需要ARDS患者或机械通气患者占比较小,数据存在选择偏倚。且研究队列中未包含基础存在ILD患者,因此对于基础ILD患者出现PC-ILD情况尚不清楚(证据列表16,证据等级B)。
【问题17】COVID-19后肺功能异常发生频率如何?
COVID-19后肺功能异常也相当常见。多项对中重度COVID-19存活患者(重症患者平均约占75%)肺功能调查发现在症状后3~6个月约50%患者仍存在弥散功能下降,20%~30%患者存在限制性通气功能障碍;12个月时异常比例分别降至约30%和15%;还有约8%患者在6~12个月时存在阻塞性通气功能障碍[34,47, 48,55](证据列表17,证据等级B)。
2. PC-ILD患者肺纤维样病变预测风险因素。
【问题18】PC-ILD患者肺纤维化病变预测风险因素有哪些?
COVID-19后6~12个月肺纤维样病变(实质带、线状实变、网状影、支气管扭曲/扩张等)独立风险因素包括:年龄(≥50岁)、急性感染高峰期肺HRCT上病变范围、急性期病情严重程度(特别是需要HFNC及以上呼吸支持者)、急性呼吸窘迫综合征、住院≥17 d、机械通气时间、出院时病变范围、出院时肺HRCT上支气管扭曲/扩张等[44,47,49, 50]。有研究显示入院时未受累肺体积定量≤80%[49],或COVID-19症状后2周时胸CT病变总评分≥18分[50]是预测6个月时肺纤维化样病变的独立预测因素。还有研究发现年龄调整后的端粒长度、血乳酸脱氢酶水平是 COVID-19 后 4 个月遗留纤维化样病变的独立危险因素[56](证据列表18,证据等级B)。
3. PC-ILD组织病理表现。
【问题19】PC-ILD组织病理表现如何?
新冠肺炎4周内肺活检常见病理表现为:(1)AEC Ⅱ型上皮细胞增生;(2)肺泡腔内吞噬细胞浸润、间质淋巴细胞为主炎症;(3)毛细血管和小静脉增生、迂曲、扩张,血管周围可见淋巴细胞炎;(4)肺泡腔及间质纤维化表现在病程2~3周后可见[57]。DAD渗出期表现和微血栓在肺活检组织病理中并不常见。然而在症状后4周内死于新冠肺炎患者尸检病理中则基本为DAD早期渗出期表现,血栓出现比例也高达44%~70%[58, 59, 60]。这可能与死亡患者病情更重的选择偏倚相关,但也可能存在机械通气等混杂因素的影响。PC-ILD组织病理表现为新冠肺炎病理表现的延续,炎症和微血管表现逐渐减轻减少,绝大部分出现肺泡腔及间质成纤维细胞增生和(或)胶原沉积表现,不同个体间病理模式上具有异质性,可呈现OP样、纤维化性NSIP样、或DAD增生期等多种不同病理模式[52, 53,58,60]。显微镜下蜂窝影、成纤维细胞灶等不可逆性纤维化表现少见,且多数出现蜂窝影表现患者存在基础ILD[52, 53],提示在具有基础ILD患者在急性COVID-19后出现不可逆性肺纤维化或基础肺纤维化加重的风险增高,需要密切随访。(证据列表19,证据等级C)
4. PC-ILD病理生理学机制。
【问题20】PC-ILD病理生理学机制有哪些?
(1)上皮细胞损伤:感染初期,SARS-CoV-2通过刺突(S)蛋白结合于靶细胞的ACE2受体,包括鼻腔、气道上皮和肺泡上皮细胞等,造成上皮细胞损伤成为后续炎症和纤维增生修复的始动因素[61, 62, 63]。(2)炎症反应:免疫反应启动,巨噬细胞、单核细胞、树突状细胞和中性粒细胞活化并迁移至病变部位,释放炎症因子,引起炎症反应[61, 62, 63]。(3)纤维增生修复:系统性炎症反应失调和肺泡上皮细胞损伤,形成促纤维化微环境,进而诱导成纤维细胞和肌成纤维细胞的增殖,对损伤部位进行修复[61, 62, 63](证据列表20,证据等级D)。
5. PC-ILD药物治疗。
【问题21】PC-ILD患者应该用激素治疗吗?
【推荐意见14】对于急性COVID-19后仍有持续或进展的呼吸道症状,肺间质病变范围仍较大者,在排除感染等其他病因后可加用激素治疗(2C,证据列表21,40票赞成,0票反对,1票弃权)
对于PC-ILD患者激素治疗缺乏高质量循证医学证据。一项研究将120例出现急性COVID症状后3~8周,肺HRCT上肺间质病变>20%肺受累,具有呼吸困难症状(mMRC≥2分)或静息低氧(SaO2<94%)或运动时SaO2下降>4%的患者,随机分为强的松龙高剂量组(40 mg/d泼尼松,逐渐减量,疗程6周)和低剂量组(10 mg/d,持续6周),两组80%以上患者均观察到影像学、症状等改善[64]。另一项研究对35例平均出院后8周仍有持续性症状、肺间质病变>15%肺受累和肺功能异常的急性COVID-19后患者应用中等剂量泼尼松龙(最大剂量0.5 mg·kg-1·d-1,逐渐减量,共3周)治疗,所有患者的症状、肺功能及影像学改善[65]。然而,上述研究都没有设立安慰剂组,因此无法评价是激素的疗效还是自然病程的自然缓解过程。尽管如此,对于急性COVID-19后仍有持续或进展的呼吸道症状,肺间质病变范围仍较大者,在排除感染等其他病因后可加用激素治疗。
【问题22】PC-ILD患者应该用抗纤维化药物治疗吗?
【推荐意见15】重症/危重症COVID-19后PC-ILD患者可加用抗纤维化药物治疗,但需要基于纤维样病变的范围、药物副作用、超适应症用药等问题,与患者协商后个体化决定。用药最佳时机、疗程尚不确定。对于轻、中型COVID-19后患者不倾向加用抗肺纤维化药物,可随访监测(2C,证据列表22,39票赞成,1票反对,1票弃权)。基础存在纤维化性ILD患者除外。
鉴于PC-ILD病理生理机制中存在明显促纤维化炎症及纤维增殖过程[61, 62, 63],特别是在重症/危重症患者,可造成显著的肺部结构和生理功能损害,在重症/危重症COVID-19患者纤维增殖过程开始时,早期加用抗肺纤维化治疗以减轻明显纤维增生造成的肺部损害、减少长期后遗症、改善患者预后从机制上推测是必要的。一些回顾性队列研究发现重症/危重症COVID-19出院患者平均起病后26 d时加用抗纤维药物,8周后约35%的患者可观察到肺间质病变显著或部分缓解[66],危重症患者急性期在甲强龙基础上联用抗纤维化药物2个月后肺功能、肺间质病变范围均显著优于仅应用甲泼尼龙者[67],机械通气患者在机械通气开始时加用抗纤维化治疗,与历史对照组相比,28 d时病死率虽然无下降,但机械通气时间显著缩短,存活者肺间质病变范围更小[68]。但另一方面,抗肺纤维化药物存在肝功能损害、消化道症状、增加出血风险等副作用,此外基于COVID-19纤维样病变在大部分患者不呈现进行性过程,通常在感染SARS-CoV2 3个月后呈现逐渐消退,成纤维细胞和肌成纤维细胞细胞外基质蛋白编码基因强烈上调也主要是在新冠肺炎起病后的第34~82天[63],因此抗纤维化药物的最佳时机、疗程尚不确定,基于上述证据推测可能在重症/危重症新冠肺炎起病后第1~3个月应用具有较好的获益/风险比,亟需开展随机对照临床试验验证抗纤维化药物在重症/危重症COVID-19患者疗效、用药时机和疗程。在缺乏循证医学证据情况下,建议重症/危重症COVID-19患者加用抗纤维化药物治疗需要基于纤维化病变的范围、药物副作用、超适应症用药等问题,与患者协商后个体化决定。对于轻、中型COVID-19患者基于用药风险和收益不倾向加用抗肺纤维化药物,可随访监测。基础存在纤维化性ILD患者除外。
作者:中国研究型医院学会呼吸病学专业委员会
通信作者:徐作军,中国医学科学院北京协和医学院 北京协和医院 呼吸和危重症医学科
引用本文: 中国研究型医院学会呼吸病学专业委员会. 新型冠状病毒感染背景下间质性肺疾病患者临床管理中国专家共识(2023年版) [J] . 中华结核和呼吸杂志, 2023, 46(12) : 1204-1218. DOI: 10.3760/cma.j.cn112147-20230922-00187.
《新型冠状病毒感染疫情下间质性肺疾病患者临床管理中国专家共识(2023年版)》编写组
组长:徐作军
执笔人:王平、韩茜、张蕙兰、彭红、代静泓、李雯
成员(以姓名汉语姓氏笔画为序):于文成(青岛大学附属医院呼吸与危重症医学科);王平(中国医学科学院北京协和医院呼吸与危重症医学科);王笑歌(沈阳胸科医院呼吸与危重症医学科);叶俏(首都医科大学附属北京朝阳医院 北京呼吸疾病研究所职业病与中毒医学科);代静泓(南京大学医学院附属鼓楼医院呼吸与危重症医学科);冯瑞娥(中国医学科学院北京协和医院病理科);刘红(郑州大学第一附属医院呼吸与危重症医学科);孙伟(四川省医学科学院 四川省人民医院呼吸与危重症医学科);李萍(山西白求恩医院呼吸与危重症医学科);李雯(浙江大学医学院附属第二医院呼吸与危重症医学科);李惠萍(同济大学附属上海市肺科医院呼吸与危重症医学科);李锋(上海市胸科医院/上海交通大学医学院附属胸科医院呼吸与危重症医学科);杨俊玲(吉林大学白求恩第二医院呼吸与危重症医学科);杨莉(浙江大学医学院附属第四医院呼吸与危重症医学科);张蕙兰(华中科技大学同济医学院附属同济医院呼吸与危重症医学科);陆志伟(皖南医学院弋矶山医院呼吸与危重症医学科);陈起航(卫生部北京医院放射科);陈娟(宁夏医科大学总医院呼吸与危重症医学科);陈碧(徐州医科大学附属医院呼吸与危重症医学科);邵池(中国医学科学院北京协和医院呼吸与危重症医学科);罗凤鸣(四川大学华西医院呼吸与危重症医学科);罗群(广州医科大学附属第一医院呼吸与危重症医学科);金洪(四川大学华西医院呼吸与危重症医学科);郑金旭(江苏大学附属医院呼吸与危重症医学科);孟莹(南方医科大学南方医院呼吸与危重症医学科);孟婕(中南大学湘雅三医院呼吸与危重症医学科);赵亚滨(中国医科大学附属第一医院呼吸与危重症医学科);胡代菊(中国科学技术大学附属第一医院呼吸与危重症医学科);饶珊珊(贵州省人民医院呼吸与危重症医学科);徐作军(中国医学科学院北京协和医院呼吸与危重症医学科);徐晓玲(中国科学技术大学附属第一医院呼吸与危重症医学科);黄慧(中国医学科学院北京协和医院呼吸与危重症医学科);曹卫军(同济大学附属上海市肺科医院呼吸与危重症医学科);曹孟淑(南京大学医学院附属鼓楼医院呼吸与危重症医学科);彭红(中南大学湘雅二院呼吸与危重症医学科);蔡后荣(南京大学医学院附属鼓楼医院呼吸与危重症医学科);蒋捍东(上海交通大学医学院附属仁济医院呼吸与危重症医学科);韩茜(广州医科大学附属第一医院呼吸与危重症医学科);魏路清(南开大学附属北辰医院呼吸与危重症医学科)
参考文献(略)


