
摘要
本文综述了2023年国内外在非小细胞肺癌(NSCLC)领域取得的临床进展并提出了相应的思考。靶向治疗和免疫治疗革新了NSCLC的临床实践。围手术期免疫治疗可以显著提高可手术的驱动基因阴性NSCLC患者的主要病理学缓解(MPR)率和无事件生存(EFS)率,因此成为可切除早中期NSCLC患者的标准治疗方案。继纳武利尤单抗联合化疗获批用于可切除的(肿瘤≥4 cm或淋巴结阳性)NSCLC患者的新辅助治疗后,国内外的程序性细胞死亡受体1(PD1)/程序性细胞死亡配体1(PD-L1)单抗相继公布了围手术期免疫治疗研究结果。国产特瑞普利单抗联合化疗显著地提高了Ⅲ期可手术的NSCLC的主要MPR率和EFS率,成为治疗围手术期NSCLC的新方案之一。同时,在间变性淋巴瘤激酶(ALK)融合突变的NSCLC患者中,辅助靶向治疗较传统化疗取得了显著的无疾病生存期(DFS)获益;在晚期表皮生长因子受体(EGFR)突变的NSCLC领域,靶向联合化疗在晚期NSCLC一线治疗中显著提升了无进展生存期(PFS)。在晚期少见突变的NSCLC上,靶向药物也取得了一定的进展。与此同时,抗体偶联药物的发展十分迅速,目前在研的人表皮生长因子受体-3(HER3)和人滋养层细胞表面糖蛋白抗原2(TROP2)的新型抗体偶联药物也展示了可喜的结果。
肺癌是国内发病率最高和死亡率最高的癌症之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的85%。较传统的化疗方案,靶向治疗和免疫治疗极大地提高了晚期NSCLC患者的生存率,5年总生存(overall survival,OS)率达到了20%~30%[1-4]。在晚期的NSCLC取得成功后,靶向治疗和免疫治疗进一步拓展到早中期可手术的NSCLC的围术期治疗中。2023年围术期NSCLC的治疗取得了重大进展,国内外的程序性细胞死亡受体1(programmed cell death 1,PD1)/程序性细胞死亡配体1(programmed cell death ligand 1,PD-L1)单克隆抗体在新辅助免疫治疗联合化疗方案中显著地提高了早期可手术的NSCLC患者的主要病理缓解(major pathological response,MPR)率和无事件生存(even-free survival,EFS)率,已成为早期可手术的NSCLC患者的标准治疗方案之一。Neotorch研究显示围术期特瑞普利单抗联合化疗方案显著提高了Ⅲ期可手术的NSCLC的主要MPR率和EFS率,该方案被国家药品监督管理局(National Medical Products Administration,NMPA)批准用于治疗Ⅲ期可手术的NSCLC患者。同时,对于间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)融合突变的NSCLC,ALINA研究公布了无疾病生存期(disease-free survival,DFS)的数据,阿来替尼辅助治疗显著性优于传统的化疗。此外,晚期NSCLC的靶向治疗也取得了一些重大的研究进展。对于表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的NSCLC患者,靶向药物联合化疗或双克隆抗体可以进一步提高患者的无进展生存期(progression-free survival,PFS)。除已获批药物新适应证以及新的联合方案的探究以外,抗体偶联药物(antibody-drug conjugates,ADC)作为一种新型的抗癌药物,在NSCLC的研究中也取得一定进展。
一、可手术NSCLC的治疗进展
(一)新辅助免疫治疗
2023年美国临床肿瘤学大会(American society of clinical oncology,ASCO)中CheckMate 816三年随访数据更新:在接受手术的IB-IIIA期的可切除NSCLC患者中,纳武利尤单抗联合化疗组的中位EFS仍未达到,化疗组为31.8个月(HR=0.67,95%CI:0.47~0.95),巩固了新辅助免疫治疗在围术期NSCLC中的地位[5]。
(二)围手术期免疫治疗
2023年国内外免疫治疗药物在围术期NSCLC的临床试验中均取得较大进展,纳入可手术的驱动基因阴性的Ⅱ-Ⅲ期的NSCLC患者,极大的提高了患者的病理完全缓解(pathological complete response,pCR)率和EFS率,建立了可手术肺癌患者治疗的新标准。
1.国内免疫药物围手术期治疗进展:Neotorch研究是第一项探索国产特瑞普利单抗在NSCLC新辅助治疗的Ⅲ期临床研究[6, 7]。纳入可切除的Ⅱ~Ⅲ期EGFR/ALK阴性的NSCLC患者,探索特瑞普利单抗联合含铂双药化疗对比化疗的疗效和安全性。该研究采用“3+1+13”围术期治疗方案:在术前完成3周期新辅助免疫联合化疗后,术后行一次免疫联合化疗,后行13周期的免疫单药维持治疗。中期分析结果显示:在Ⅲ期NSCLC患者中,特瑞普利单抗联合化疗组的MPR(48.5%比8.4%)和pCR率(24.8%比1.0%)均显著高于对照组(表1)。特瑞普利单抗联合化疗组的EFS也显著优于化疗组(中位EFS:未达到比15.1个月;HR=0.40,95%CI:0.277~0.565;P<0.001)。此外,特瑞普利单抗联合化疗组对比化疗组的OS也显示出获益趋势(HR=0.62,95%CI:0.38~1.00;P=0.05)。特瑞普利单抗联合化疗组安全性可控。目前NMPA已批准特瑞普利单抗联合化疗用于可切除IIIA~IIIB期NSCLC的围术期治疗。
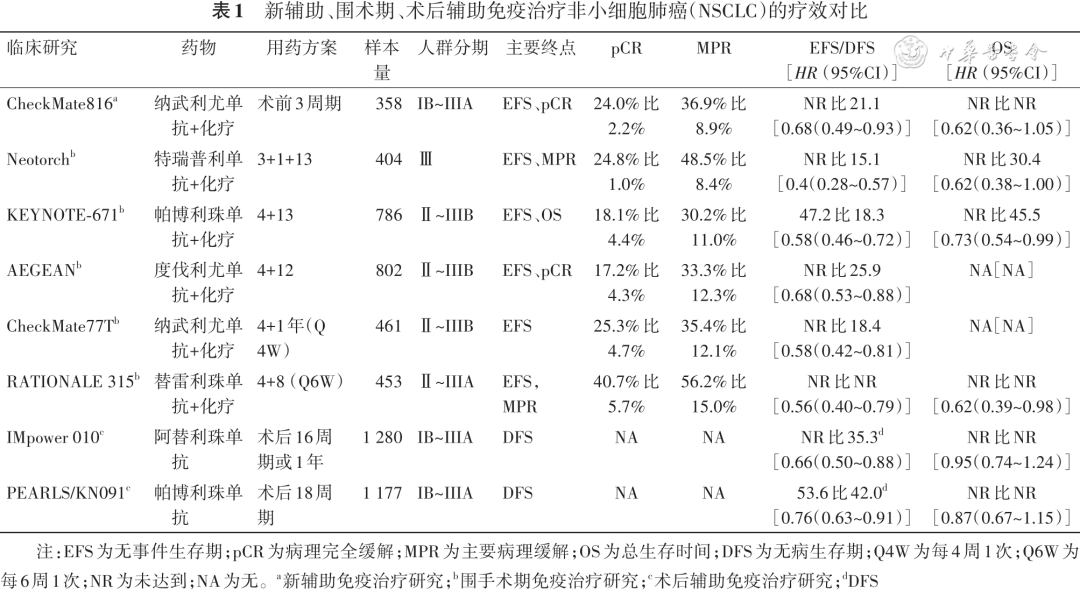
RATIONALE315研究是一项探索替雷利珠单抗联合化疗应用在围手术期NSCLC治疗的研究[11]。替雷利珠单抗组的主要MPR率达到56.2%,显著高于单独接受化疗组的15.0%(P<0.001),pCR率为40.7%,同样高于接受化疗组的5.7%(P<0.001),EFS的数据尚未公布。
2.国外免疫药物围手术期治疗进展:KEYNOTE-671研究是一项研究帕博利珠单抗联合化疗对比化疗治疗可切除NSCLC的随机双盲Ⅲ期研究[8]。该研究采用“三明治式”围术期治疗方案,即术前使用4周期帕博利珠单抗联合化疗治疗,术后使用13个周期的帕博利珠单抗维持治疗。结果显示:帕博利珠单抗联合化疗组的主要MPR率和pCR率均优于化疗组(主要MPR率:30.2%比11.0%,P<0.001;pCR率:18.1%比4.0%;P<0.001)。帕博利珠单抗联合化疗组的EFS也显著优于化疗组(中位EFS:47.2 比18.3个月,HR=0.59,95%CI:0.48~0.72;P<0.00001);帕博利珠单抗联合化疗组的OS也优于化疗组(未达到比52.4,HR=0.72,95%CI:0.56~0.93;P=0.00517)。
AEGEAN研究是一项探索4周期新辅助度伐利尤单抗联合化疗在可手术的NSCLC的疗效和安全性的Ⅲ期临床研究[9]。在中期分析结果中,度伐利尤单抗联合化疗组的EFS明显长于化疗组(中位EFS:未达到比25.6个月;HR=0.68,95%CI:0.53~0.88;P=0.004)。在pCR率方面,度伐利尤单抗联合化疗组也显著高于化疗组(17.2%比4.3%;P<0.001)。而且度伐利尤单抗联合化疗组在各亚组分析中均得到EFS和pCR获益,包括PD-L1<1%的NSCLC患者。值得注意的是,该研究还入组了51例具有EGFR突变的肺癌患者,度伐利尤单抗联合化疗组和单纯化疗组的中位EFS分别为30.8个月和19.6个月(HR=0.86,95%CI:0.35~2.19)。
CheckMate 77T研究进一步探索了纳武利尤单抗在“三明治式”围术期治疗模式中的应用[10]。与CheckMate 816研究不同,在CheckMate 77T研究中NSCLC患者手术后继续使用辅助纳武利尤单抗维持治疗。与单独化疗相比,新辅助纳武利尤单抗联合化疗及术后辅助纳武利尤单抗较单纯化疗改善了EFS(中位EFS:未达到比18.4个月;HR=0.58,95%CI:0.42~0.81;P<0.001),此外新辅助纳武利尤单抗联合化疗也提高了pCR率(25.3%比4.7%)和主要MPR率(35.4%比12.1%)。
目前围术期免疫治疗还存在诸多问题需要继续探讨,比如新辅助免疫、围术期免疫治疗或术后辅助免疫治疗方案的选择策略,新辅助手术治疗的时机的选择,如何进一步优化疗效评价的标准(MPR、pCR等),是否有更好的肿瘤生物标志物进行优势人群的筛选等。
(三)术后辅助靶向治疗
1.EGFR突变的NSCLC的辅助靶向治疗:在NSCLC的辅助靶向治疗领域,公布的研究主要聚焦在EGFR突变和ALK融合突变的NSCLC患者中。Ⅲ期ADAURA研究纳入了IB~IIIA期EGFR突变的完全切除术后的NSCLC患者,旨在评估奥希替尼用于术后辅助治疗的疗效和安全性[12]。2023年ASCO会议进一步公布了该研究的OS结果[13]。Ⅱ~IIIA期NSCLC患者在接受奥希替尼辅助治疗后,5年总生存率达到85%,较安慰剂组(73%)有显著提高(HR=0.49,95%CI:0.33~0.73;P<0.001)。总入组人群(IB~IIIA期)的5年总生存率为88%比78%(HR=0.49,95%CI:0.34~0.70;P<0.001)。在各个亚组分析中,均观察到了奥希替尼组的OS获益优势,各亚组的HR值与总人群HR值基本保持一致。在复发后的治疗中,大多数患者仍然接受EGFR-TKI治疗,其中安慰剂组有43%的患者接受后续奥希替尼治疗。ADAURA研究OS数据的公布,证明了奥希替尼辅助靶向治疗可以把DFS转化为OS的获益,从而提高患者的生存率。目前美国食品药品监督管理局(Food and Drug Administration,FDA)和NMPA已批准奥希替尼用于早期EGFR突变的NSCLC根治术后的辅助靶向治疗。
2.ALK融合突变NSCLC的辅助靶向治疗:2023年另一项重要研究是ALK融合突变的NSCLC的辅助靶向治疗ALINA研究[14]。ALINA研究是一项随机、开放标签的Ⅲ期临床研究,旨在比较阿来替尼与铂类化疗在可切除的IB~IIIA期ALK融合突变的NSCLC患者辅助治疗的疗效与安全性。2023年欧洲临床肿瘤学会(European Society for Medical Oncology,ESMO)上公布了ALINA研究的DFS数据[14]。在总人群中,阿来替尼较传统化疗可显著地延长患者的DFS(未达到比41.3个月,HR=0.24;95%CI:0.13~0.43;P<0.001)。阿来替尼和化疗组的2年的DFS率分别为93.8%和63.0%,3年的DFS率分别为88.3%和53.3%。安全性方面,两组的严重不良事件率类似。该研究为ALK融合突变的早期NSCLC完全切除术后辅助治疗领域带来了新的治疗方案,有望改变目前的临床实践。期待未来ALINA研究的OS数据更新。
从RADIANT研究提示辅助靶向治疗可能使EGFR突变的肺癌患者获益到ADAURA研究的获批,辅助靶向治疗经过了长达近10年时间的探索,如今ADAURA和ALINA研究的结果公布后最终尘埃落定,奥希替尼或阿来替尼辅助靶向治疗相较传统化疗可以为EGFR突变或ALK融合突变的根治性术后的NSCLC提供获益。目前,辅助靶向治疗仍存在诸多问题需要继续探索,比如其他少见驱动基因突变的可切除肺癌患者是否能从相应辅助靶向治疗中获益?此外,是否需要加入化疗、辅助治疗时长、微小残留病灶检测(minimal residual disease detection,MRD)的应用等亦是亟需解决的问题。
二、局部晚期和晚期NSCLC的治疗进展
(一)靶向治疗
靶向治疗的出现开启了肺癌精准治疗的大门,是驱动基因突变肺癌患者的优选治疗方案。
1.EGFR突变的NSCLC:EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)已成为晚期EGFR突变的NSCLC患者的标准一线治疗。2023年我国三代EGFR-TKI贝福替尼在EGFR突变的晚期NSCLC患者的一线治疗的研究数据公布,贝福替尼组对比埃克替尼的中位PFS为22.1比13.8个月(HR=0.49,95%CI:0.36~0.68;P<0.001)[15]。2023年5月31日,NMPA批准了贝福替尼在EGFR突变的晚期NSCLC的一线治疗。目前,我国上市的EGFR-TKI三代药物有奥希替尼、阿美替尼、伏美替尼和贝福替尼。第三代EGFR-TKI药物的疗效相似,客观缓解率(objective response rate,ORR)为70%~80%,中位PFS为18.9~22.1个月[16]。由于EGFR-TKI单药治疗的疗效难有提升,EGFR-TKI联合治疗成为了探索疗效突破的新方向。
(1)EGFR-TKI联合化疗:FLAURA2是一项全球Ⅲ期、开放标签的研究,旨在评估奥希替尼联合含铂化疗对比奥希替尼单药作为EGFR突变的晚期NSCLC一线治疗的疗效和安全性,主要终点为研究者评估的PFS[17]。在奥希替尼联合化疗组中,研究者评估的中位PFS为25.5个月,显著高于奥希替尼单药的16.7个月(HR=0.62,95%CI:0.48~0.80;P<0.001),达到了主要研究终点。同时,奥希替尼联合化疗组在各个研究亚组中具有一致的PFS获益。在EGFR 19号外显子缺失(exon 19 deletion,ex19del)患者中,奥希替尼联合化疗组和奥希替尼单药组的中位PFS分别为27.9和19.4个月(HR=0.60);在EGFR L858R患者中,两组患者的中位PFS分别为24.7和13.9个月(HR=0.63)。对于EGFR L858R突变的肺癌患者,奥希替尼联合化疗组的获益程度接近EGFR ex19del亚组的患者。值得关注的是,在脑转移亚组中,奥希替尼联合化疗对比奥希替尼单药可提升约11个月的中位PFS(24.9比13.8个月)。在疗效应答方面,两组的ORR类似,分别为83%和76%。但在安全性方面,奥希替尼联合化疗组的不良反应发生率更高(>3级不良反应率:64%比27%)。在数据截止时,PFS和OS尚未得出结论。奥希替尼联合化疗组与单药组的PFS分别为30.6和27.8个月(HR=0.70,95%CI:0.52~0.93;P=0.0132),中位OS暂未达到(HR=0.90,95%CI:0.65~1.24;P=0.5238)。
(2)EGFR-TKI联合埃万妥单抗:MARIPOSA研究是一项评估EGFR-间质上皮转化因子(mesenchymal-epithelial transition,MET)双特异性抗体——埃万妥单抗联合拉泽替尼对比第三代EGFR-TKI单药(奥希替尼或拉泽替尼)用于EGFR突变的晚期NSCLC一线治疗的疗效及安全性的Ⅲ期研究[18]。该研究共纳入1 074例患者,按2∶2:1随机分配至埃万妥单抗联合拉泽替尼组、奥希替尼组与拉泽替尼组。研究结果显示,与奥希替尼相比,埃万妥单抗联合拉泽替尼组可显著延长患者的PFS,可降低30%的疾病进展或死亡风险(23.7比16.6个月;HR=0.70,95%CI:0.58~0.85;P<0.001)。此外,埃万妥单抗联合拉泽替尼组的中位持续缓解时间(duration of response,DoR)长达25.8个月,优于奥希替尼单药近9个月(25.8比16.8个月)。在数据截止时,尚未得出OS数据(HR=0.80,95%CI:0.61~1.05;P=0.11)。在安全性方面,与FLAURA2研究类似,埃万妥单抗联合拉泽替尼组的不良反应发生率更高(>3级不良反应率:75%比43%),且联合用药增加了静脉血栓栓塞的风险。
总之,目前EGFR突变的晚期NSCLC患者的一线标准治疗仍为EGFR-TKI单药,FLAURA2和MARIPOSA两项研究为EGFR突变的肺癌患者带来了两种可能提升患者生存获益的新的治疗选择。虽然在以上两项研究均观察到PFS的获益,但不良作用增加,尤其是>3级不良反应率,同时静脉用药相比口服TKI治疗增加了患者返院的负担。期待两项研究的最终OS结果。
2.EGFR-TKI耐药后的EGFR突变NSCLC的后线治疗:MARIPOSA-2研究评估了埃万妥单抗联合拉泽替尼与化疗在奥希替尼耐药患者中的疗效与安全性[19]。该研究共纳入657例患者,按2∶2:1随机化到埃万妥单抗联合化疗与拉泽替尼组(ACP-L)、单纯化疗组和埃万妥单抗联合化疗组(ACP)。结果显示,3组患者中位PFS分别为8.3、4.2和6.3个月。与单纯化疗相比,ACP-L(HR=0.44,95%CI:0.35~0.56;P<0.001)和ACP方案(HR=0.48,95%CI:0.36~0.64;P<0.001)均可显著延长患者PFS,均降低疾病进展或死亡风险达50%以上。安全性方面,联合治疗组的不良反应发生率更高,在ACP-L组,化疗组及ACP组中,>3级不良反应率分别为92%,48% 和72%。此外,ACP-L组中的血液学毒性和静脉血栓栓塞(22%)发生率更高。
在EGFR-TKI治疗失败的患者中使用免疫联合化疗治疗及抗血管生成药物是另一个重要的研究方向。根据ORIENT-31研究数据,2023年5月9日NMPA批准信迪利单抗联合贝伐珠单抗、培美曲塞和顺铂用于EGFR-TKI治疗耐药的EGFR突变的晚期非鳞状NSCLC患者[20]。另外,2023年ESMO大会公布了Ⅲ期ATTLAS研究的结果,该研究共入组228例EGFR突变(n=215)或ALK融合突变的且经过TKI治疗失败的NSCLC患者[21]。该试验达到了主要终点,支持ORIENT-31研究结果。联合阿替利珠单抗、贝伐珠单抗和化疗(ABCP)相较化疗组可以延长患者的中位PFS(8.5比5.6个月;HR=0.62,95%CI:0.45~0.86;P=0.004)。接受ABCP治疗的患者的ORR显著高于化疗(分别为69.5%比41.9%;P<0.001),与PFS的数据获益一致。此外,2023年ASCO会议公布了KEYNOTE-789研究的结果,该研究旨在探索免疫联合化疗方案在EGFR-TKI耐药的晚期NSCLC患者的后线治疗的作用[22]。遗憾的是,该组合未能提高PFS(5.6比5.5个月;HR=0.8,95%CI:0.65~0.97;P=0.0122)和OS的获益(15.9 比14.7个月;HR=0.84,95%CI:0.69~1.02;P=0.0362)。根据统计效能,该研究的PFS和OS的P值的有效界值分别是0.011 7和0.011 8,因此该研究的PFS和OS均是阴性结果,未达到研究终点。但在后续的亚组分析中发现,免疫联合化疗在肿瘤细胞阳性比例分数(tumor proportion score,TPS)≥1%的患者中,OS有延长的趋势。
至此,在探索EGFR-TKI耐药的后线治疗方案中,免疫联合化疗的策略以失败告终(CheckMate722、KEYNOTE-789研究),但免疫联合化疗和抗血管生成药物治疗的研究取得PFS的阳性结果,说明在免疫联合化疗的基础上,加入抗血管生成药物治疗可以提高患者的PFS获益。此外,在驱动基因突变的NSCLC患者中,除了免疫联合方案,目前也还在研究第四代EGFR-TKI、MET抑制剂联合治疗和针对HER3和TROP2的ADC药物等,期待这些研究给患者带来生存的获益。同时,考虑到后线耐药的肺癌患者的肿瘤内异质性增大,未来可能需要开发新的生物标志物,根据患者的肿瘤生物学特性匹配对患者最优的治疗方案,使患者的获益最大化。
3.EGFR少见突变NSCLC:
(1)EGFR 20号外显子插入突变(EGFR exon 20 insertion,EGFR ex20ins):EGFR ex20ins在整体EGFR突变患者中占比10~12%[23]。舒沃替尼是一款口服的、不可逆结合的多靶点EGFR-TKI,对EGFR ex20ins的NSCLC具有显著的抗肿瘤活性。WU-KONG6(NCT05712902)是一项多中心Ⅱ期临床研究,评估了舒沃替尼在含铂化疗失败后、携带EGFR ex20ins的NSCLC患者疗效和安全性[24]。该研究的总体ORR达60.8%。不论EGFR ex20ins突变亚型,是否接受过免疫治疗,接受舒沃替尼治疗的患者均有明显的获益,特别是存在脑转移的患者,ORR达到48.4%。2023年8月23日,NMPA批准了舒沃替尼用于治疗既往经含铂化疗治疗失败且存在EGFR ex20ins的晚期NSCLC的患者。
埃万妥单抗是一款EGFR-MET双特异性抗体。PAPILLON研究评估了埃万妥单抗联合化疗在EGFR ex20ins的晚期NSCLC一线治疗的疗效和安全性[25]。该研究的主要研究终点为PFS。埃万妥单抗联合化疗组的ORR显著高于化疗组(73%比47%)。同时,埃万妥单抗联合化疗组的PFS也显著优于单纯化疗方案(中位PFS:11.4比6.7个月;HR=0.40,95%CI:0.30~0.53;P<0.001),在各亚组分析中,PFS获益均保持一致,包括中枢神经系统转移的患者。安全性方面,埃万妥单抗联合化疗方案的安全性可控,>3级不良反应率为75%(化疗组54%)。综上,PAPILLON研究在一线治疗EGFR ex20ins的晚期NSCLC中显示了良好的抗肿瘤效果,有望成为EGFR ex20ins一线治疗选择。
(2)EGFR其他少见突变:除了EGFR ex20ins,EGFR 少见突变还包括EGFR G719X、S768I、L861Q 等。既往 LUX-Lung 3、6研究显示,阿法替尼对EGFR少见突变的NSCLC具有较强的抗肿瘤活性。ACHILLES/TORG1834进一步探索了阿法替尼对比化疗一线治疗EGFR少见突变的NSCLC的疗效[26]。该研究的主要研究终点为PFS。阿法替尼组的中位PFS显著长于化疗组(10.6比5.7个月,HR=0.422,95%CI:0.256~0.694;P<0.001),12个月PFS率为42.1%比19.3%。同时阿法替尼组的ORR率为61.4%,而化疗组为47.1%(P=0.207)。无论在单一突变或复合突变上,阿法替尼均优于化疗组。两组≥3级AE发生率相似,分别为43.8%和37.1%。
4.ALK融合突变的NSCLC:ALK融合突变的肺癌患者使用ALK-TKI的治疗效果较好,被称为肺癌的“钻石突变”。2023年的世界肺癌大会(world conference on lung cancer,WCLC)会议上公布了开放、多中心的Ⅲ期INSPIRE研究的结果[27]。该研究旨在探索伊鲁阿克对比克唑替尼在一线治疗ALK融合突变晚期NSCLC的作用。主要研究终点为PFS。在随访25个月后,伊鲁阿克组较克唑替尼组的PFS得到显著改善,两组的中位PFS分别为27.7和14.6个月(HR=0.344,98.02%CI:0.226~0.523),达到了PFS的研究终点。在DoR和颅内疾病控制率(disease control rate,DCR)等次要终点上,伊鲁阿克组也明显优于克唑替尼。在安全性上,伊鲁阿克与克唑替尼类似,安全性良好。2024年1月16日,中国NMPA批准伊鲁阿克用于ALK融合突变的晚期NSCLC的一线治疗。
5.MET 14号外显子(MET exon 14,METex14)跳跃突变NSCLC:2023年我国获批用于治疗METex14突变的靶向药物有谷美替尼、伯瑞替尼、特泊替尼。此外,赛沃替尼是我国自主研发的高选择性的口服MET抑制剂,已被NMPA批准用于METex14突变的NSCLC的后线治疗。2023年WCLC会议公布了赛沃替尼一线治疗METex14突变的局部晚期或转移性的NSCLC患者的单臂研究结果[28]。在该研究的队列2中,ORR达到了59.5%,DCR为95.2%。接受赛沃替尼治疗的中位PFS达到了12.6个月(95%CI:8.5个月~未达到)。该研究显示了赛沃替尼在初治的METex14突变的晚期NSCLC患者中具有良好的抗肿瘤活性。另外,CHRYSALIS研究入组了97例METex14突变的晚期NSCLC患者,探索埃万妥单抗在其中的抗肿瘤活性[29]。在整体人群的ORR为33%。在初治患者、未经MET抑制剂治疗的经治患者中,ORR分别达到了56%、46%。埃万妥单抗的不良反应主要为皮疹、输液相关反应和甲沟炎等,3级及以上的不良反应发生率较高,达到了42%。
6.RET融合NSCLC:2022年10月塞普替尼被NMPA批准用于治疗RET融合突变的局部晚期或转移性NSCLC患者。LIBRETTO-431研究是一项开放标签、随机对照的Ⅲ期临床研究,旨在评估塞普替尼单药对比帕博利珠单抗联合化疗在一线治疗RET融合的晚期NSCLC的疗效与安全性[30]。该试验的主要研究终点是PFS。对于随机到对照组的患者,在进展时允许交叉到塞普替尼治疗。塞普替尼组较化疗+帕博利珠单抗组显著延长了13.6个月的PFS(中位PFS:24.8比11.2个月,HR=0.46,95%CI:0.31~0.70;P<0.001),降低了54%的进展或死亡风险。此外,塞普替尼组的ORR(84%比65%)和中位DoR(24.2比11.5个月)也更高。
7.BRAF V600E突变NSCLC:中国临床肿瘤学会(CSCO)指南推荐达拉非尼+曲美替尼一线治疗BRAF V600E突变的NSCLC,成为BRAF V600E突变晚期NSCLC患者首选的一线标准治疗。PHAROS(NCT03915951)是一项探索思考芬尼(encorafenib)联合比美替尼(binimetinib)治疗BRAF V600E突变的转移性NSCLC患者的开放标签、单臂的临床试验[31]。该研究共纳入98例BRAF V600E突变的转移性NSCLC患者。研究的主要疗效终点为ORR。结果显示,在59例未经治疗患者中,恩考芬尼联合比美替尼治疗的ORR为75%(95%CI:62%~85%);在39例既往接受过治疗的患者中,ORR为46%(95%CI:30%~63%),中位DoR为16.7个月。药物不良反应方面,最常见的不良反应为恶心、腹泻、疲劳等。基于此,于2023年10月11日FDA批准恩考芬尼联合比美替尼用于治疗BRAF V600E突变的晚期NSCLC患者。
(二)免疫治疗
免疫治疗+化疗是目前驱动基因阴性NSCLC的标准一线治疗。KEYNOTE-189和KEYNOTE-407研究显示帕博利珠单抗+化疗的5年总生存率达到20%左右,显著优于传统的化疗(约10%)[2,32]。CheckMate 9LA研究是一项双免联合化疗一线治疗NSCLC的临床研究,联合治疗组接受每3周一次的纳武利尤单抗、每6周一次的伊匹木单抗和2个周期的化疗,单独化疗组接受4个周期的化疗[33]。2023年ASCO年会中更新了CheckMate 9LA的4年OS数据[33]。纳武利尤单抗联合伊匹木单抗及2周期化疗为转移性NSCLC带来持久的生存获益,中位的OS为15.8个月对比11个月(HR=0.75,95%CI:0.63~0.87),不论PD-L1的表达状态和组织学类型都有获益,但鳞癌亚组使用双免联合化疗的获益更显著。
CHOICE-01研究是一项旨在评估特瑞普利单抗联合化疗对比化疗一线治疗EGFR/ALK阴性的晚期NSCLC患者的有效性和安全性的随机、双盲Ⅲ期临床研究[34]。该研究同时纳入肺腺癌和肺鳞癌患者。2023 ASCO大会公布了其最终的总生存数据,特瑞普利单抗联合化疗组相比单纯化疗组可显著延长一线晚期NSCLC患者的总生存,总体人群的中位OS分别为23.8 比17.0个月(HR=0.73,95%CI:0.57~0.93;P=0.0108)。
(三)ADC药物
ADC药物是通过链接子把小分子细胞毒性药物与单克隆抗体连接起来的新型抗肿瘤药物,也被称为“魔法子弹”,它可以特异性靶向肿瘤细胞,兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性。目前有多款ADC药物在肺癌领域展开研究,并取得了显著的临床效果(表2)。
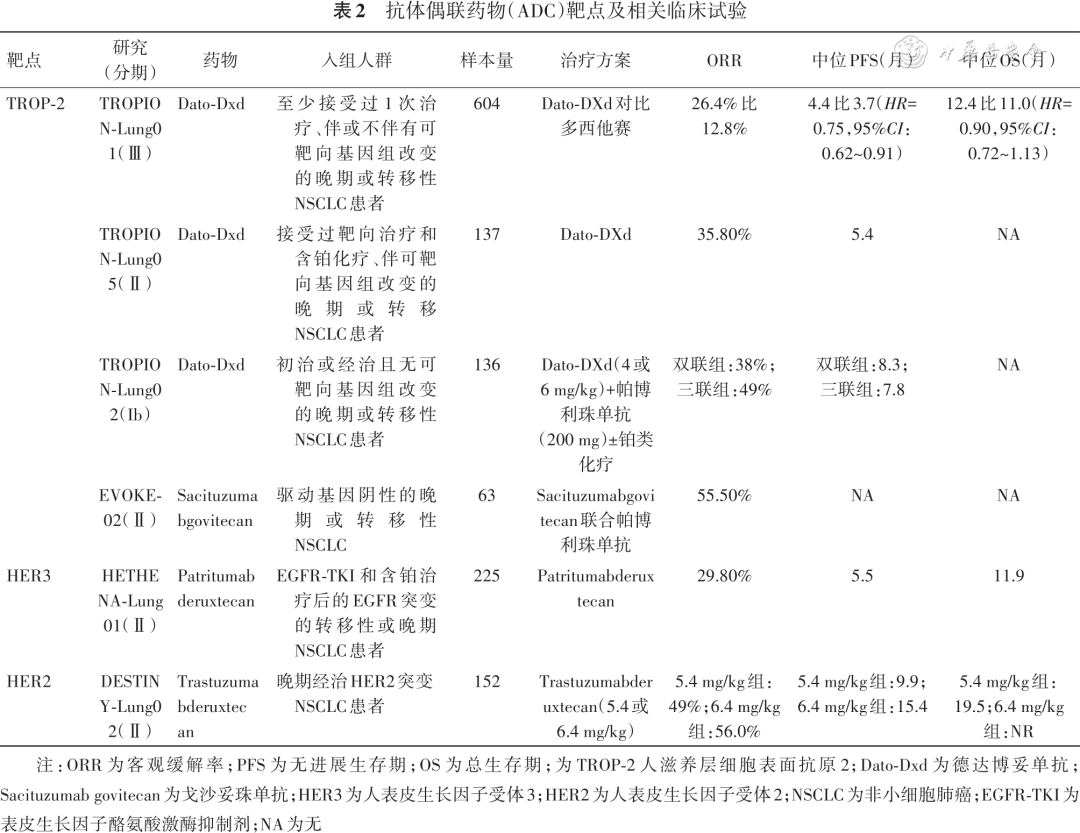
1.TROP-2 ADC药物:德达博妥单抗(Datopotamab deruxtecan,Dato-DXd)是一种靶向跨膜蛋白TROP-2的ADC药物,它由人源化的抗 TROP2 IgG1单克隆抗体与拓扑异构酶Ⅰ抑制剂通过稳定的四肽连接子偶联而成。目前Dato-DXd在肺癌领域正在开展多项研究。TROPION-Lung01是一项全球多中心、开放标签的Ⅲ期试验,旨在评估Dato-DXd单药对比多西他赛在既往至少接受过1次治疗、伴或不伴有驱动基因突变(包括EGFR、ALK、ROS1等)的晚期NSCLC患者的有效性和安全性[35]。研究共入组604例受试者,其中,43.1%的人群既往接受过≥2线治疗,按1∶1比例随机分配至Dato-DXd或多西他赛组治疗。在整体人群中,Dato-DXd组较多西他赛组显示了显著的PFS获益(4.4个月比3.7个月,HR=0.75,95%CI:0.62~0.91;P=0.004)。Dato-DXd和多西他赛组的ORR分别为26.4%和12.8%。值得注意的是,在非鳞癌亚组中,患者的PFS获益更佳,Dato-DXd相比多西他赛的PFS分别为5.6和3.7个月(HR=0.63,95%CI:0.51~0.78)。尚未得出OS数据,Dato-DXd较多西他赛组显示出延长的趋势(12.4比11.0个月,HR=0.90,95%CI:0.72~1.13)。Dato-DXd药物安全可耐受,≥3级治疗相关不良反应率为24.6%,远低于多西他赛组的41.4%。
TROPION-Lung05研究进一步验证Dato-DXd在驱动基因突变的NSCLC患者中的疗效。TROPION-Lung05是一项单臂、开放标签的Ⅱ期临床研究,评估了Dato-DXd在≥1线靶向治疗和含铂化疗治疗进展的伴有驱动基因突变的晚期NSCLC患者的疗效及安全性[36]。该研究共计入组137例患者,超过70%的患者既往接受过≥3线治疗。结果显示,接受Dato-DXd治疗组的ORR为35.8%(95%CI:27.8%~44.4%),DCR为78.8%,中位PFS达5.4个月。值得注意的是,亚组分析显示EGFR突变亚组的疗效更好,ORR达到43.6%,DCR为82.1%,中位PFS可达5.8个月。TROPION-Lung05研究进一步证明了Dato-DXd在驱动基因突变的经治的晚期NSCLC患者中的作用,显示出令人鼓舞的抗肿瘤活性和安全性。
TROPION-Lung02是一项评估Dato-DXd(4或6 mg/kg)+帕博利珠单抗±铂类化疗方案在初治或经治的晚期NSCLC患者的安全性和有效性[37]。2023年ASCO公布初步结果显示,总人群中双联组的ORR为38%(95%CI:27%~51%),三联组ORR为49%(95%CI:37%~61%)。在一线治疗人群中,双联组的ORR为50%(95%CI:32%~68%);三联组的ORR为57%(95%CI:42%~70%)。此外,Dato-DXd与PD-L1抑制剂度伐利尤单抗±卡铂联合治疗NSCLC的研究(TROPION-Lung04研究)也正在进行中[38]。
戈沙妥珠单抗(Sacituzumab govitecan)是另外一个针对TROP2的ADC,2023年WCLC公布了戈沙妥珠单抗联合帕博利珠单抗一线治疗驱动基因阴性的晚期或转移性NSCLC的Ⅱ期EVOKE-02研究结果[39]。在总体人群中,患者的ORR为55.5%,DCR为82%。在PD-L1 TPS≥50%的人群中的ORR率高达69%,DCR为86%。最常见的不良反应是腹泻(50%)、贫血(41%)和乏力(32%)。
2.其他ADC药物:HETHENA-Lung01是一项多中心、开放标签、双臂Ⅱ期试验,旨在评估Patritumab deruxtecan(一款HER3 ADC)在接受EGFR-TKI治疗进展后的EGFR突变的局部晚期或转移性NSCLC患者中的疗效和完全性[40]。在225例耐药后的EGFR突变的NSCLC患者中,Patritumab deruxtecan组患者的ORR率为29.8%(95%CI:23.9~36.2)。中位PFS为5.5个月(95%CI:5.1~5.9个月),中位OS为11.9个月(95%CI:11.2~13.1个月)。
DESTINY-Lung02研究探索了德曲妥珠单抗(Trastuzumab deruxtecan,DS-8201)在经治的HER2突变的晚期NSCLC中的疗效和安全性[41]。主要研究终点为ORR。在接受5.4 mg/kg剂量的德曲妥珠单抗组的患者中,ORR为49%(95%CI:39.0%~59.1%),中位PFS分别为9.9个月(95%CI:7.4个月~未达到),在接受6.4 mg/kg剂量的德曲妥珠单抗组中,ORR为56.0%(95%CI:41.3%~70.0%),中位PFS达到了15.4个月(95%CI:8.3个月~未达到)。
总之,2023年靶向和免疫治疗药物进一步向围术期的NSCLC患者突破,为早中期可手术的NSCLC患者提供更多获益的治疗方案。在少见突变上,2023年的药物研究也呈现出精彩纷呈的景象,越来越多的针对少见突变靶点的研究公布,给患者提供更多的治疗选择。同时ADC药物作为一种新型的抗肿瘤药物,在NSCLC的研究进行得如火如荼,显示出了广阔的治疗前景。随着越来越多的靶向和免疫药物上市,未来需要探索如何优化组合治疗方案,根据生物标志物选择潜在可获益的患者接受精准治疗,为患者带来最大的生存获益及最小化的不良反应将成为未来的努力发展方向。
利益冲突
所有作者声明不存在利益冲突
参考文献
[1]de CastroG, KudabaI, WuYL, et al. Five-year outcomes with pembrolizumab versus chemotherapy as first-line therapy in patients with non-small-cell lung cancer and programmed death ligand-1 tumor proportion score≥1% in the Keynote-042 study[J]. J Clin Oncol, 2023, 41(11):1986-1991. DOI: 10.1200/JCO.21.02885.
[2]NovelloS, KowalskiDM, LuftA, et al. Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer: 5-year update of the phase Ⅲ Keynote-407 study[J]. J Clin Oncol, 2023, 41(11):1999-2006. DOI: 10.1200/JCO.22.01990.
[3]DyerM, GreenM, Joness, et al. Estimating long-term survival of previously untreated patients with EGFR mutation-positive (EGFRm) advanced non-small cell lung cancer (NSCLC) who received osimertinib in the FLAURA study[J]. J Clin Oncol, 2019, 37(15Suppl): e20560-e20560. DOI: 10.1200/JCO.2019.37.15_suppl.e20560.
[4]杨莹, 李子明, 朱可喻, 等. 非小细胞肺癌治疗年度进展2022[J]. 中华医学杂志, 2023, 103(14):1074-1081. DOI: 10.3760/cma.j.cn112137-20221212-02628.
[5]SpicerJ, FordePM, ProvencioM, et al. Clinical outcomes with neoadjuvant nivolumab (N)+chemotherapy (C) vs C by definitive surgery in patients (pts) with resectable NSCLC: 3-y results from the phase 3 CheckMate 816 trial[J]. J Clin Oncol, 2023, 41(16 Suppl): 8521-8521. DOI: 10.1200/JCO.2023.41.16_suppl.8521.
[6]LuS, ZhangW, WuL, et al. Perioperative Toripalimab plus chemotherapy for patients with resectable non-small cell lung cancer: the neotorch randomized clinical trial[J]. JAMA, 2024, 331(3):201-211. DOI: 10.1001/jama.2023.24735.
[7]LuS, WuL, ZhangW, et al. Perioperative toripalimab+platinum-doublet chemotherapy vs chemotherapy in resectable stage Ⅱ/Ⅲ non-small cell lung cancer (NSCLC): Interim event-free survival (EFS) analysis of the phase Ⅲ Neotorch study[J]. J Clin Oncol, 2023, 41(36Suppl): 425126-425126. DOI: 10.1200/JCO.2023.41.36_suppl.425126.
[8]WakeleeH, LibermanM, KatoT, et al. Perioperative pembrolizumab for early-stage non-small-cell lung cancer[J]. N Engl J Med, 2023, 389(6):491-503. DOI: 10.1056/NEJMoa2302983.
[9]HeymachJV, HarpoleD, MitsudomiT, et al. Perioperative durvalumab for resectable non-small-cell lung cancer[J]. N Engl J Med, 2023, 389(18):1672-1684. DOI: 10.1056/NEJMoa2304875.
[10]CasconeT, AwadMM, SpicerJD, et al. LBA1 CheckMate 77T: Phase Ⅲ study comparing neoadjuvant nivolumab (NIVO) plus chemotherapy (chemo) vs neoadjuvant placebo plus chemo followed by surgery and adjuvant NIVO or placebo for previously untreated, resectable stage Ⅱ-IIIb NSCLC[J]. Ann Oncol, 2023, 34(S2): S1295-S1295. DOI: 10.1016/j.annonc.2023.10.050.
[11]YueD, WangW, LiuH, et al. LBA58 Pathological response to neoadjuvant tislelizumab (TIS) plus platinum-doublet (PtDb) chemotherapy (CT) in resectable stage Ⅱ-IIIA NSCLC patients (pts) in the phase Ⅲ (Ph3) RATIONALE-315 trial[J]. Ann Oncol, 2023, 34(S2): S1299-S1299. DOI: 10.1016/j.annonc.2023.10.054.
[12]WuYL, TsuboiM, HeJ, et al. Osimertinib in resected EGFR-mutated non-small-cell lung cancer[J]. N Engl J Med, 2020, 383(18):1711-1723. DOI: 10.1056/NEJMoa2027071.
[13]TsuboiM, HerbstRS, JohnT, et al. Overall survival with osimertinib in resected EGFR-mutated NSCLC[J]. N Engl J Med, 2023, 389(2):137-147. DOI: 10.1056/NEJMoa2304594.
[14]SolomonBJ, AhnJS, DziadziuszkoR, et al. LBA2 ALINA: efficacy and safety of adjuvant alectinib versus chemotherapy in patients with early-stage ALK+non-small cell lung cancer (NSCLC)[J]. Ann Oncol, 2023, 34(S2): S1295-S1296. DOI: 10.1016/j.annonc.2023.10.051.
[15]LuS, ZhouJ, JianH, et al. Befotertinib (D-0316) versus icotinib as first-line therapy for patients with EGFR-mutated locally advanced or metastatic non-small-cell lung cancer: a multicentre, open-label, randomised phase 3 study[J]. Lancet Respir Med, 2023, 11(10):905-915. DOI: 10.1016/S2213-2600(23)00183-2.
[16]LuHL, JieGL, WuYL. Epidermal growth factor receptor-targeted therapy for the treatment of non-small cell lung cancer: a review of phase Ⅱ and Ⅲ trials[J]. Expert Opin Emerg Drugs, 2022, 27(2):111-126. DOI: 10.1080/14728214.2022.2063836.
[17]PlanchardD, JännePA, ChengY, et al. Osimertinib with or without chemotherapy in EGFR-mutated advanced NSCLC[J]. N Engl J Med, 2023, 389(21):1935-1948. DOI: 10.1056/NEJMoa2306434.
[18]ChoBC, FelipE, SpiraAI, et al. LBA14 Amivantamab plus lazertinib vs osimertinib as first-line treatment in patients with EGFR-mutated, advanced non-small cell lung cancer (NSCLC): Primary results from MARIPOSA, a phase Ⅲ, global, randomized, controlled trial[J]. Ann Oncol, 2023, 34(S2): S1306-S1306. DOI: 10.1016/j.annonc.2023.10.062.
[19]PassaroA, WangJ, WangY, et al. Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase Ⅲ MARIPOSA-2 study[J]. Ann Oncol, 2024, 35(1):77-90. DOI: 10.1016/j.annonc.2023.10.117.
[20]LuS, WuL, JianH, et al. Sintilimab plus chemotherapy for patients with EGFR-mutated non-squamous non-small-cell lung cancer with disease progression after EGFR tyrosine-kinase inhibitor therapy (ORIENT-31): second interim analysis from a double-blind, randomised, placebo-controlled, phase 3 trial[J]. Lancet Respir Med, 2023, 11(7):624-636. DOI: 10.1016/S2213-2600(23)00135-2.
[21]ParkS, KimTM, HanJY, et al. Phase Ⅲ, Randomized study of atezolizumab plus bevacizumab and chemotherapy in patients with EGFR-or ALK-mutated non-small-cell lung cancer (ATTLAS, KCSG-LU19-04)[J]. J Clin Oncol, 2023:JCO2301891. DOI: 10.1200/JCO.23.01891.
[22]YangJC-H, LeeDH, LeeJ-S, et al. Pemetrexed and platinum with or without pembrolizumab for tyrosine kinase inhibitor (TKI)-resistant, EGFR-mutant, metastatic nonsquamous NSCLC: Phase 3 KEYNOTE-789 study[J]. J Clin Oncol, 2023, 41(17suppl): LBA9000-LBA9000. DOI: 10.1200/JCO.2023.41.17_suppl.LBA9000.
[23]郏博, 吕超, 常建华, 等. 非小细胞肺癌非常见突变靶向治疗研究进展[J]. 中华医学杂志, 2022, 102(13):969-976. DOI: 10.3760/cma.j.cn112137-20211008-02215.
[24]WangM, FanY, SunM, et al. Sunvozertinib for the treatment of NSCLC with EGFR Exon20 insertion mutations: The first pivotal study results[J]. J Clin Oncol, 2023, 41(16 suppl): 9002-9002. DOI: 10.1200/JCO.2023.41.16_suppl.9002.
[25]ZhouC, TangKJ, ChoBC, et al. Amivantamab plus chemotherapy in NSCLC with EGFR exon 20 insertions[J]. N Engl J Med, 2023, 389(22):2039-2051. DOI: 10.1056/NEJMoa2306441.
[26]MiuraS, TanakaH, MisumiT, et al. LBA66 Afatinib versus chemotherapy for treatment-naïve non-small cell lung cancer with a sensitizing uncommon epidermal growth factor receptor mutation: A phase Ⅲ study (ACHILLES/TORG1834)[J]. Ann Oncol, 2023, 34(S2): S1310-S1311. DOI: 10.1016/j.annonc.2023.10.067.
[27]ShiY, ChenJ, YangR, et al. OA03.05 a randomized, phase 3 study of Iruplinalkib (WX-0593) vs Crizotinib in locally advanced or metastatic ALK+non-small cell lung cancer (NSCLC)[J]. J Thorac Oncol, 2023, 18(11): S49-S50. DOI: 10.1016/j.jtho.2023.09.034.
[28]LuS, YuY, GuoQ, et al. OA21.03 A phase 3b study of 1L Savolitinib in patients with locally advanced or metastatic NSCLC harboring MET exon 14 mutation[J]. J Thorac Oncol, 2023, 18(11): S92-S93. DOI: 10.1016/j.jtho.2023.09.104.
[29]LeighlN, ChoBC, HiretS, et al. OA21.04 Amivantamab in patients with advanced NSCLC and MET exon 14 skipping mutation: results from the CHRYSALIS study[J]. J Thorac Oncol, 2023, 18(11): S93-S94. DOI: 10.1016/j.jtho.2023.09.105.
[30]ZhouC, SolomonB, LoongHH, et al. First-line Selpercatinib or chemotherapy and Pembrolizumab in RET fusion-positive NSCLC[J]. N Engl J Med, 2023, 389(20):1839-1850. DOI: 10.1056/NEJMoa2309457.
[31]RielyGJ, SmitEF, AhnMJ, et al. Phase Ⅱ, open-label study of Encorafenib plus Binimetinib in patients with brAF(V600)-mutant metastatic non-small-cell lung cancer[J]. J Clin Oncol, 2023, 41(21):3700-3711. DOI: 10.1200/JCO.23.00774.
[32]GarassinoMC, GadgeelS, SperanzaG, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the phase 3 KEYNOTE-189 study[J]. J Clin Oncol, 2023, 41(11):1992-1998. DOI: 10.1200/JCO.22.01989.
[33]CarboneDP, CiuleanuT-E, SchenkerM, et al. First-line (1L) nivolumab (N)+ipilimumab (I)+chemotherapy (C) vs C alone in patients (pts) with metastatic NSCLC (mNSCLC) from CheckMate 9LA: 4-y clinical update and outcomes by tumor histologic subtype (THS)[J]. J Clin Oncol, 2023, 41(17Suppl): LBA9023-LBA9023. DOI: 10.1200/JCO.2023.41.17_suppl.LBA9023.
[34]WangJ, WangZ, WuL, et al. Final overall survival and biomarker analyses of CHOICE-01: A double-blind randomized phase 3 study of toripalimab versus placebo in combination chemotherapy for advanced NSCLC without EGFR/ALK mutations[J]. J Clin Oncol, 2023, 41(16 Suppl): 9003-9003. DOI: 10.1200/JCO.2023.41.16_suppl.9003.
[35]AhnMJ, LisbergAE, Paz-AresL, et al. 509MO Datopotamab deruxtecan (Dato-DXd) vs docetaxel in previously treated advanced/metastatic (adv/met) non-small cell lung cancer (NSCLC): Results of the randomized phase Ⅲ study TROPION-Lung01[J]. Ann Oncol, 2023, 34(S4): S1665-S1666. DOI: 10.1016/j.annonc.2023.10.588.
[36]Paz-AresL, AhnMJ, LisbergAE, et al. 1314MO TROPION-Lung05: Datopotamab deruxtecan (Dato-DXd) in previously treated non-small cell lung cancer (NSCLC) with actionable genomic alterations (AGAs)[J]. Ann Oncol, 2023, 34(S2): S755-S756. DOI: 10.1016/j.annonc.2023.09.2348.
[37]GotoY, SuW-C, LevyBP, et al. TROPION-Lung02: Datopotamab deruxtecan (Dato-DXd) plus pembrolizumab (pembro) with or without platinum chemotherapy (Pt-CT) in advanced non-small cell lung cancer (aNSCLC)[J]. J Clin Oncol, 2023, 41(16 Suppl): 9004-9004. DOI: 10.1200/JCO.2023.41.16_suppl.9004.
[38]PapadopoulosKP, BrunoD, KitazonoS, et al. OA05.06 Datopotamab Deruxtecan (Dato-DXd)+Durvalumab±Carboplatin in advanced/mNSCLC: Initial results from phase 1b TROPION-Lung04[J]. J Thorac Oncol, 2023, 18(11): S55-S55. DOI: 10.1016/j.jtho.2023.09.043.
[39]ChoBC, DolsMC, Reyes CabanillasR, et al. OA05.04 Sacituzumab Govitecan+Pembrolizumab in 1L metastatic non-small cell lung cancer: preliminary results of the EVOKE-02 study[J]. J Thorac Oncol, 2023, 18(11): S54-S54. DOI: 10.1016/j.jtho.2023.09.041.
[40]YuHA, GotoY, HayashiH, et al. HERTHENA-Lung01, a Phase Ⅱ Trial of Patritumab Deruxtecan (HER3-DXd) in epidermal growth factor receptor-mutated non-small-cell lung cancer after epidermal growth factor receptor tyrosine kinase inhibitor therapy and platinum-based chemotherapy[J]. J Clin Oncol, 2023, 41(35):5363-5375. DOI: 10.1200/JCO.23.01476.
[41]GotoK, GotoY, KuboT, et al. Trastuzumab Deruxtecan in patients with HER2-mutant metastatic non-small-cell lung cancer: primary results from the randomized, phase Ⅱ DESTINY-Lung02 Trial[J]. J Clin Oncol, 2023, 41(31):4852-4863. DOI: 10.1200/JCO.23.01361.
通信作者:陆舜,上海交通大学医学院附属胸科医院 上海市肺部肿瘤临床医学中心,上海 200030,Email:shunlu@sjtu.edu.cn.
引用本文:揭光灵, 杨莹, 虞永峰, 等. 非小细胞肺癌治疗年度进展2023 [J/OL] . 中华医学杂志, 2024,104:网络预发表. DOI: 10.3760/cma.j.cn112137-20240202-00257.
本文转载自订阅号「中华医学杂志」(ID:nmjc1915)
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


